-
.(10分)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g) 2NO2(g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算20s—40s内用N2O4表示的平均反应速率为________;
②计算在80℃时该反应的平衡常数K=________;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)________;
④要增大该反应的K值,可采取的措施有(填序号)________。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
⑤在同条件下,如果将0.40mol的N2O4气体充入2L已经抽空的固定容积的绝热密闭容器中,最终达到平衡后n(NO2)________0.60 mol(填“> ”、“<”或“=”)。
-
(10分)在80℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为________。
(2)计算在80℃时该反应的平衡常数K=________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)下图是80℃时容器中N2O4物质的量的变化曲线,

请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
-
80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| N(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 mol·L-1·s-1
(2)计算在80℃时该反应的平衡常数K= ;
(3)要增大该反应的K值,可采取的措施有(填序号);
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
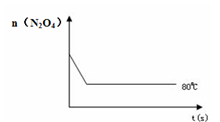
(4)如右图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
-
80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 110 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算20s—40s内用N2O4表示的平均反应速率为 mol/(L.s)
②计算在80℃时该反应的N2O4的转化率= 此温度下
③反应进行至110s后将反应混合物的温度降低,混合气体的颜色 ;如果此时加入NO2,则此时容器内颜色 (填“变浅”、“变深”或“不变”)
④要增大该反应NO2 的体积分数,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.通入N2气体
C.使用高效催化剂 D.升高温度
-
在80℃时,将0.40mol的N24气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4⇌2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)
n(mol) | | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s一40s内用N2O4表示的平均反应速率为______mol•L-1•S-1;
(2)计算在80℃时该反应的平衡常数K=______(请注明单位).
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”.“变深”或“不变”)______;
(4)要增大该反应的K值,可采取的措施有(填序号)______:
A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N24物质的量的变化曲线,请在该图中补画出该反应在60℃时N24物质的量的变化曲线.

-
(1)80℃时,将0.40 mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 (g)  2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 110 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①上表中c =___________;e =_____________
②计算20s—40s内用NO2表示的平均反应速率为________ mol/(L·s)
③计算在80℃时该反应的平衡常数K=________;
(2)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4,此时,平衡朝_______方向移动;建立新平衡后,N2O4的转化率_______75%(填“>、<或=”);
(3)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4和0.1mol NO2时,v正________ v逆(填“>、<或=”)
-
(8分)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算20s—40s内用N2O4表示的平均反应速率为
②计算在80℃时该反应的平衡常数K=________;
③反应进行至l00s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)________;
④要增大该反应的K值,可采取的措施有(填序号)________;
A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度
-
在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2 △H>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算0~40 s内用N2O4表示的平均反应速率为____________mol· L-1·s-1。
(2)计算在80 ℃时该反应的平衡常数K=___________。
(3)40s时,NO2的的浓度b=_______mol/L,反应最迟到________s到达平衡状态
(4)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有___________(填序号)。
A、增大N2O4的起始浓度 B、向混合气体中通入NO2
C、使用高效催化剂 D、升高温度
-
(20分)在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g) 2NO2(g)ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为____________mol· L-1·s-1。
(2)计算在80 ℃时该反应的平衡常数K=___________。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色___________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
A.增大N2O4的起始浓度 B.向混合气体中通入NO
C.使用高效催化剂 D.升高温度
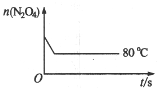
(5)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线。

-
在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:

(1)计算20~40 s内用N2O4表示的平均反应速率为_________mol/( L • s)。
(2)计算在80℃时该反应的平衡常数K=__________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有_________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
2NO2(g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:



