-
铁的化合物在生产生活和科学实验中应用广泛:
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO 和H2。已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6 kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2( g) △H=+206.4 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0 kJ/mol
①反应Fe2O3(s)+3CH4(g) 2Fe(s)+3CO(g)+6H2(g)的△H=________。
2Fe(s)+3CO(g)+6H2(g)的△H=________。
②若该反应在5 L的密闭容器中进行,5 min后达到平衡,测得体系中固体质量减少0.96g,则该段时间内CO 的平均反应速率为________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是________( 选填序号)。
a.c(CH2)=c(CO) b.固体的总质量不变
c.v(CO)与v(H2)的比值不变 d.混合气体的平均相对分子质量不变
④该反应的化学平衡常数的负对数pK 随反应温度T的变化曲线如下图。
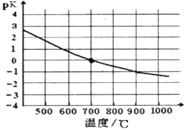
试用平衡移动原理解释该曲线的变化规律________________。若700℃时测得平衡时,H2 浓度为1.0mol·L-1,则CH4的平衡转化率为_________。
(2)菱铁矿的主要成分是FeCO3,实验室中可以通过FeSO4与足量NaHCO3 溶液混合制得FeCO3,有关反应的离子方程式为________________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3 的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_______________________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe 为阳极,NaOH 为电解质溶液进行电解制备,写出阳极的电极反应式_________________________________________。
-
金属铁盐或其氧化物在生产生活和科学实验中应用广泛。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g) 2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为__________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是______(选填序号)
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:______________________。若700℃时测得c平衡(H2)=1.0mol·L-1,则CH4的转化率为_________。

(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:____________________。已知Ksp[FeCO3】=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_____________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:_____________________。
-
氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺
流程如下:试回答下列问题:
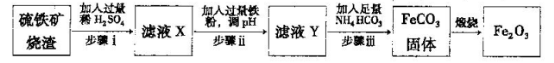
(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、ⅱ、ⅲ都要进行的操作名称是__________________。
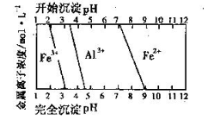
(5)结合下图,判断步骤ⅱ中调节溶液的pH不高于_________________。
(6)已知

计算反应Fe2+(aq)+2HCO3-(aq) FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。
(7)在空气中煅烧FeCO3生成氧化铁的化学方程式为____________。
(8)结合所学化学知识,请你设计在实验室里从上述的硫铁矿烧渣中提取氧化铁的另一种简单方案。
-
(14分)铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+1、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,该反应中是 元素被还原 。
2Cu+SO2反应制取粗铜,该反应中是 元素被还原 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为: 温度控制在50℃-60℃的原因除了加快反应速率外,还有 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 。
(3)现向Cu、Cu2O和CuO组成的混合物中,加入2 L 0.6 mol·L-1 HNO3溶液恰好使混合物溶解,同时收集到4480 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式 。若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。若混合物中含0.2 mol Cu,将该混合物与稀硫酸充分反应,消耗H2SO4的物质的量为 mol。
-
铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是________ 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是________ 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃-60℃的两个原因除了加快反应速率外,还有________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO, 其猜想可用化学方程式表示为:
Cu + H2SO4 ________
________
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是________(填字母)
a.Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式。若将上述混合物用足量的H2加热还原,所得到固体的质量为________g。若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为。
-
(13分)铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃-60℃的两个原因除了加快反应速率外,还有 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO, 其猜想可用化学方程式表示为:
Cu + H2SO4
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是 (填字母)
a.Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式 。若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
-
铁及其化合物在生产生活中应用广泛,如铁红(Fe2O3)可作为颜料,电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。 aFe2(SO4) 3·b(NH4) 2SO4·cH2O,(硫酸铁铵)常用于生活饮用水、工业循环水的净化处理。
(1)现有一含有Fe2O3和Fe3O4的混合物样品,测得n(Fe):n(O)=1:1.375,则该样品中Fe2O3的物质的量分数为___________。(结果保留2位有效数字)
(2)CuO和Fe2O3的混合物9.6 g在高温下与足量的CO充分反应,反应后全部气体用100mL 1.2mol/L Ba(OH)2 溶液吸收,生成15.76 g白色沉淀。则吸收气体后溶液中的溶质的化学式为__________,混合物中CuO和Fe2O3的物质的量之比为___________。
(3)称取某硫酸铁铵样品7.00 g,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到1.07 g沉淀;向另一份溶液中加入含0.025 molBa (NO3)2的溶液,恰好完全反应,求该硫酸铁铵的化学式_________。
(4)现将一块敷有铜箔的绝缘板浸入800mL 3mol/L的FeCl3溶液中,一段时间后,将该线路板取出,向溶液中加入铁粉56.0 g,充分反应后剩余固体51.2 g,求所得溶液中溶质的物质的量浓度_________(忽略反应前后溶液体积的变化)。
-
氮及其化合物在生活和生产中应用广泛。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:2N2(g)+6H2O(1) 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)
H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)  H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)
H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)  H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
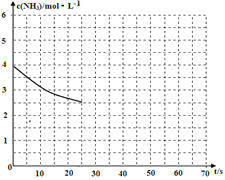
② 若保持温度和容器体积不变,向平衡体系中再通入2molNH3和2molH2O,此时v正______v逆(填“>”、“=”或“<”)
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业 生产NaN3主要是在175℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式_______________________。
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式_______。
-
碳的化合物在生产生活和环境保护中应用广泛。
Ⅰ.碳氧化合物的综合利用
(1)利用CO可有效降低柴油发动机在空气过量条件下的NO 排放。
已知:反应Ⅰ:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-746 kJ·mol-1
N2(g)+2CO2(g) △H=-746 kJ·mol-1
反应Ⅱ:4CO(B)+2NO2(g) N2(g)+4CO2(g) △H=-1200kJ·mol-1
N2(g)+4CO2(g) △H=-1200kJ·mol-1
则反应NO2(g)+CO(g) CO2(g)+NO(g)的△H=__________kJ·mol-1。
CO2(g)+NO(g)的△H=__________kJ·mol-1。
在一定条件下,将NO2与CO以体积比1:2置于恒容密闭容器中发生反应Ⅱ,下列能说明反应达到平衡状态的是______________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.NO2 与CO的体积比保持不变
(2)工业上利用CO 与Cl2在活性炭催化下合成光(COCl2),反应方程式为: CO(g) +Cl2(g)  COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
(3)利用“组合转化技术”可将CO2 转化成乙烯,反应方程式为:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
a.N点正反应速率一定大于M 点正反应速率
b.250℃时,催化剂的催化效率最大
c.M点平衡常数比N点平衡常数大
d.随着温度升高,乙烯的产率增大

Ⅱ.碳氢化合物的综合利用
利用甲烷的裂解可以制得多种化工原料,甲烷裂解时发生的反应有:2CH4(g) C2H4(g)+2H2(g),2CH4(g)
C2H4(g)+2H2(g),2CH4(g) C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
(4)1725 ℃时,向1L恒容密闭容器中充入0.3 molCH4达到平衡,则反应2CH4(g) C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
-
(14分)近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 = -1214.6 KJ/mol
② 2 CO (g) + O2(g) = 2 CO2 (g) ΔH2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) 的△H =________。
(2)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是:CH4 + 10 OH―― 8e-= CO32-+ 7 H2O;通入O2的一极,其电极反应式是________。
(3)若用石墨做电极电解500 ml饱和食盐水,写出电解反应的离子方程式为:________ ;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH=________。
(4)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
CO (g) + H2O (g)  CO2 (g) + H2 (g),得到如下三组数据:
CO2 (g) + H2 (g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min |
| H2O | CO | CO2 | CO |
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
① 实验1中以υ(H2) 表示的反应速率为________ 。
② 实验2中的平衡常数是________ (计算结果保留两位小数)。
③ 该反应的正反应为 ________(填“吸”或“放”)热反应。
④ 若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),
则a、b应满足的关系是________ (用含a、b的数学式表示)。
2Fe(s)+3CO(g)+6H2(g)的△H=________。






