-
氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺
流程如下:试回答下列问题:
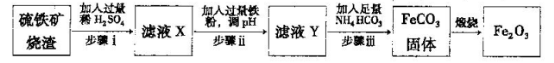
(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、ⅱ、ⅲ都要进行的操作名称是__________________。
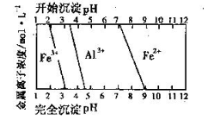
(5)结合下图,判断步骤ⅱ中调节溶液的pH不高于_________________。
(6)已知

计算反应Fe2+(aq)+2HCO3-(aq) FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。
(7)在空气中煅烧FeCO3生成氧化铁的化学方程式为____________。
(8)结合所学化学知识,请你设计在实验室里从上述的硫铁矿烧渣中提取氧化铁的另一种简单方案。
-
金属铁盐或其氧化物在生产生活和科学实验中应用广泛。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g) 2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为__________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是______(选填序号)
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:______________________。若700℃时测得c平衡(H2)=1.0mol·L-1,则CH4的转化率为_________。

(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:____________________。已知Ksp[FeCO3】=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_____________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:_____________________。
-
铁的化合物在生产生活和科学实验中应用广泛:
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO 和H2。已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6 kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2( g) △H=+206.4 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0 kJ/mol
①反应Fe2O3(s)+3CH4(g) 2Fe(s)+3CO(g)+6H2(g)的△H=________。
2Fe(s)+3CO(g)+6H2(g)的△H=________。
②若该反应在5 L的密闭容器中进行,5 min后达到平衡,测得体系中固体质量减少0.96g,则该段时间内CO 的平均反应速率为________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是________( 选填序号)。
a.c(CH2)=c(CO) b.固体的总质量不变
c.v(CO)与v(H2)的比值不变 d.混合气体的平均相对分子质量不变
④该反应的化学平衡常数的负对数pK 随反应温度T的变化曲线如下图。
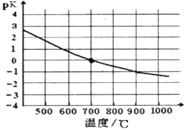
试用平衡移动原理解释该曲线的变化规律________________。若700℃时测得平衡时,H2 浓度为1.0mol·L-1,则CH4的平衡转化率为_________。
(2)菱铁矿的主要成分是FeCO3,实验室中可以通过FeSO4与足量NaHCO3 溶液混合制得FeCO3,有关反应的离子方程式为________________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3 的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_______________________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe 为阳极,NaOH 为电解质溶液进行电解制备,写出阳极的电极反应式_________________________________________。
-
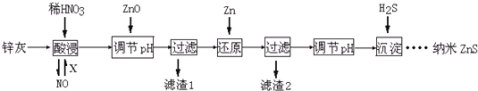
(12分)纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
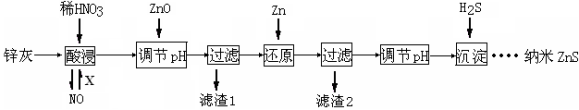
请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式 。
(2)将酸浸的尾气循环利用,加入的X气体可以是 。
(3)流程中加入ZnO调pH的目的是 。
(4)滤渣2中的成分是 。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol·L-1,则溶液中S2—浓度大于 mol·L一1,才生成ZnS沉淀。
(6)试设计简单实验方案,判断所得ZnS样品颗粒是否为纳米级 。
-
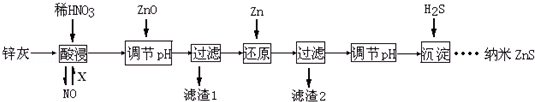
纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛.以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:(已知Ksp=3.810﹣38; Ksp=210﹣20;Ksp(ZnS)=1.610﹣24)
下列说法不正确的是:
A. 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++ NO3﹣═3Fe3++NO↑+5H2O
B. 将酸浸的尾气循环利用,加入的X气体可以是O2
C. 滤渣2中的成分是Zn和Fe
D. 当溶液中Zn2+浓度为小于1.010﹣5mol•L﹣1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2﹣浓度应大于1.610﹣19mol•L﹣1
-
纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛.以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
(已知Ksp[Fe(OH)3]=3.8×10﹣38; Ksp[Cu(OH)2]=2×10﹣20;Ksp(ZnS)=1.6×10﹣24)
下列说法不正确的是
A.酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++NO ═3Fe3++NO↑+5H2O
═3Fe3++NO↑+5H2O
B.将酸浸的尾气循环利用,加入的X气体可以是O2
C.滤渣2中的成分和Zn和Fe
D.当溶液中Zn2+浓度为小于1.0×10﹣5mol•L﹣1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2﹣浓度应大于1.6×10﹣19mol•L﹣1
-
下列说法正确的是( )
A.用高氯酸与碳酸钙反应制取二氧化碳可证明氯元素非金属性大于碳元素
B.糖类、油脂、蛋白质在一定条件下都能发生水解反应
C.硅单质在电子工业上应用广泛,可做光导纤维
D.石油的裂化产生气体、植物油以及苯甲酸均能使酸性高锰酸钾溶液褪色
-
碳酸亚铁(FeCO3)是菱铁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3则生成Fe2O3。据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) + 6H2(g)-Q
2Fe(s) + 3CO(g) + 6H2(g)-Q
(1)原子序数为26的铁元素位于元素周期表的第________周期__________族。
(2)反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g。则该段时间内H2的平均反应速率为____________________。
(3)将固定质量的Fe2O3(s)和CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是__________________。
A、CH4的转化率等于CO的产率
B、混合气体的平均相对分子质量不变
C、v正(CO):v逆(H2)=1︰2
D、固体的总质量不变
(4)FeO可用CO进行还原,已知:t℃时, FeO(s) +CO(g)  Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
(5)Fe2O3还可用来制备FeCl3 ,FeCl3在水溶液中的水解分三步:
Fe3+ + H2O Fe(OH)2+ + H+ K1
Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O Fe(OH)2+ + H+ K2
Fe(OH)2+ + H+ K2
Fe(OH)2+ + H2O Fe(OH)3 + H+ K3
Fe(OH)3 + H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是____________________。
(6)通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
A、加水稀释 B、加入少量NaCl固体
C、升温 D、加入少量Na2CO3固体
-
纳米氧化钴在半导体和微电子行业应用广泛,某些金属废料中含有Co元素,从废料(含Co3O4、Al2O3、Li2O、Fe2O3等物质) 中制备高纯度的纳米级钴的氧化物,流程如下
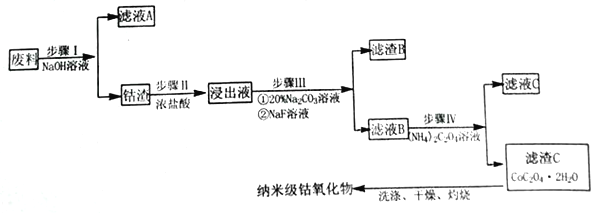
已知:
①LiF 难溶于水,Li2CO3微溶于水;
②钴元素常见的化合价为+2 和+3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中发生的离子反应方程式_______________;
(2)步骤II加浓盐酸的作用是_______________;
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为_______________; 滤渣 B 的主要成分为_________________;
(4)简述如何检验滤液B中是否还有残留的Fe3+:_______________;
(5) 经过反复洗涤、干燥后称重,将质量为3.66gCoC2O4·2H2O进行灼烧,残留固体质量如图所示。

210℃~290℃时若生成两种气体,则发生反应的化学方程式为_______________,400℃~500℃所得固体的化学式为_______________;
-
【化学——选修2:化学与技术】
元素铝是在生产、生活中应用广泛的金属元素。
(1)氧化铝是一种耐高温材料,也是工业上制取铝的原料。从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下图所示:

体A的主要成分是 (填化学式,下同),固体X的主要成分是 。
②滤液E中溶质的主要成分是 ,写出该溶质的一种用途: 。
③在滤液D中通入过量CO2时反应的离子方程式为 。
(2)工业上电解氧化铝冶炼铝时加入冰晶石(Na3AlF6)的作用是 。在电解池的工作过程中,需要不断补充阳极材料(石墨),原因是 。
(3)一种新型高效净水剂PAFC——聚合氯化铁铝[AlFe(OH)nCl6-n]m(n<5,m<10)可广泛应用于日常生活用水和工业污水的处理。下列有关PAFC的说法正确的是 (填序号)。
A.PAFC中铁元素显+2价
B.PAFC用于净水时,比用相同物质的量的氯化铝和氯化铁的pH改变小
C.PAFC可看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性或强碱性溶液中都能稳定存在



FeCO3(s)+H2CO3(aq)的平衡常数为_______。







