-
(1)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。 已知:
2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:
N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化
B.断裂3 mol H-H键的同时形成6 mol N-H键
C.N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中的压强不随时间变化
(3)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式是____________。
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)  2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g)  2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。
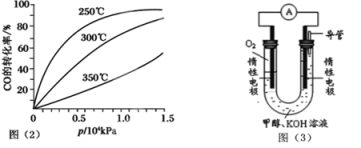
(4)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
①该电池工作时,OH-向 极移动(填“正”或“负”)。
②该电池正极的电极反应式为 。
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)一定条件下将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则NO2的转化率 =
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡
CH3OH(g)。CO在不同温度下的平衡
转化率与压强的关系如图(2)所示。该反应ΔH 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。
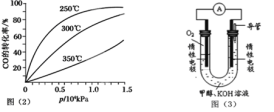
(4)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
① 该电池工作时,OH- 向 极移动(填“正”或“负”)。
② 该电池正极的电极反应式为 。
-
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2) 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
2NO(g)+O2(g)  2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH=________ kJ/mol。
SO3(g)+NO(g)的ΔH=________ kJ/mol。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
-
(8分) 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)对于反应:2SO2(g)+O2(g) 2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)  2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)对于反应:2SO2(g)+O2(g)  2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________________________;υ(SO3)=_______________________。
2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________________________;υ(SO3)=_______________________。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)  2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO
-
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1 (b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为_____mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(2)己知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mo1
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mo1
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mo1
请写出H2燃烧热的热化学方程式______________________________________。
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式_______________________________。
-
(9分)研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
① CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1 (a>0)
② 2CO(g)+2NO (g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1 (b>0)
若用标准状况下 3.36LCO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
(2)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?
若1molCH4还原NO2至N2的整个过程中放出的热量为867kJ,则ΔH2=______________。
-
研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
此反应的热化学方程式是_______。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下22.4L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_mol,放出的热量为___kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,则ΔH2=__。
2SO3(g) ΔH= -196.6kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。

