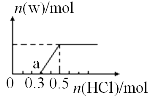-
化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
(1)汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221.0l kJ·mol-1
CO2(g)=C(s)+O2(g) △H=+393.5kJ·mol-1
则①反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=_________kJ·mol-1。
②在600K时,将3.0mol NO、3.6mol CO通入固定容积3L的密闭容器中,20min后,反应达平衡,测得N2的浓度为0.2mol·L-1,则NO的转化率 =__________,反应平衡常数K=____________(保留两位有效数字)。
=__________,反应平衡常数K=____________(保留两位有效数字)。
③若改变下列条件之一,达新平衡时NO的体积分数一定减小的是_________(填序号)。
a.增加CO的量 b.加入催化剂 c.降低温度 d.扩大容器体积
(2)某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
①探究浓度对平衡的影响
已知四氯合钴(Ⅱ)离子(蓝色)与六水合钴(Ⅱ)离子(粉红色)之间存在如下平衡:[CoC14]2-+6H2O [Co(H2O)6]2++4C1-。甲同学向某已呈现紫色的氯化钴溶液中通入HC1,发现溶液变为________色;乙同学向溶液中加水,平衡移动方向为_______(填“向右”、“向左”或“不移动”),说明原因__________________________________。
[Co(H2O)6]2++4C1-。甲同学向某已呈现紫色的氯化钴溶液中通入HC1,发现溶液变为________色;乙同学向溶液中加水,平衡移动方向为_______(填“向右”、“向左”或“不移动”),说明原因__________________________________。
②运用数字化实验探究压强对平衡的影响:
将一收集满干燥NO2的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。

由图可知:增大压强,该混合气体的颜色变化为__________________________。
-
汽车排气管内的催化转化器可实现尾气无毒处理。
已知: ;
; ;
; ;则反应
;则反应 的
的 ________
________ 。
。
-
研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。下列说法能说明恒温恒容条件下的反应;2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ·mol-1已达到化学平衡的是 。
A.单位时间内消耗了2moINO的同时消耗的2moICO
B.CO与CO2的物质的量浓度相等的状态
C.气体密度保持不变的状态
D.气体平均摩尔质量保持不变的状态
(2)NO2与SO2混合可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)。
SO3(g)+NO(g)。
将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示。由图(纵轴代表正反应速率)可知下列说法正确的是 (填字母)。
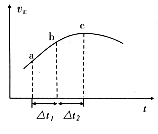
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
(3)CO在实际中有以下应用:用Li2CO3和Na2CO3熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气作为正极助燃气,制得在650℃下工作的燃料电池。完成有关的电极反应式。
负极反应式:2CO+2CO32-一4e-=4CO2 正极反应式: 。
(4)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:
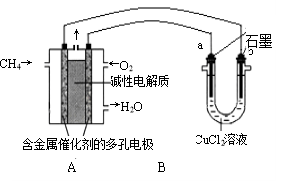
请回答:①甲烷燃料电池的负极反应式是 。
②当A中消耗0.15 mol氧气时,B中 极(填”a”或”b”)增重__ __g。
-
汽车尾气(含烃类、CO、NO与SO2等)是城市空气主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气循环的无毒气体,其反应原理是:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0.下列说法中错误的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂条件
C.该反应常温下能自发进行,高温和催化剂只是加快反应的速率
D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒
-
(5分)汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1,ΔS=-145 J·(mol·K)-1.
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
(2)若升高温度,则该反应的平衡常数________ (填“增大”、“减小”或“不变”).
(3)判断该条件下反应(填能、不能)自发.
-
I.为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。热化学反应方程式为 2NO(g)+2CO(g) N2(g)+2CO2(g) △=-746.5kJ• mol-1,将1.0 mol NO和1.0 mol CO充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示。
N2(g)+2CO2(g) △=-746.5kJ• mol-1,将1.0 mol NO和1.0 mol CO充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示。
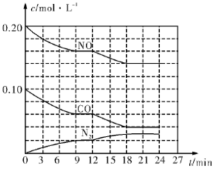
(1)CO在0〜9 min内的平均反应速率w(CO)= mol • L-1•min-1(保留两位有效数字);第12 min时改变的反应条件可能为 。
A.升高温度 B.减小压强 C.降低温度 D.加催化剂
(2)该反应在第24 min时已达到平衡状态,此时C02的体积分数为 (数值保留至小数点后一位),化学平衡常数K= (数值保留至小数点后一位)。
Ⅱ.能源的开发利用与人类社会的可持续发展息息相关。
(1)已知:Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H1=a kJ • mol-1
2Fe(s)+3CO(g) △H1=a kJ • mol-1
CO(g) + O2 (g)
O2 (g) CO2 (g) △H2=ckJ• mol-1
CO2 (g) △H2=ckJ• mol-1
4Fe(s)+3O2(g) 2Fe2O3 (s) △H3=c kJ • mol-1
2Fe2O3 (s) △H3=c kJ • mol-1
则C的燃烧热△H=________kJ•mol-1。
(2)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s )+CO2 (g)=2CO(g)
B.NaOH(aq) + HCl(aq)=NaCl(aq) +H2O(l)
C.2CO(g) +O2(g)=2CO2 (g )
D.2H2O(1 )=2H2(g)+O2(g )
(3 )若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池, 请写出该原电池的负极反应: 。
-
为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① ∆H=180.5kJ·
∆H=180.5kJ·
②C和CO的燃烧热(∆H)分别为-393.5kJ· 和-283kJ·
和-283kJ·
则2NO(g)+2CO(g)=N2(g)+2CO2(g) ∆H=_________kJ·
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
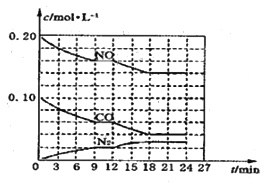
①CO在0—9min内的平均反应速率 =__________ mol·L-1·
=__________ mol·L-1· (保留两位有效数字);第12min时改变的反应条件可能为_________。
(保留两位有效数字);第12min时改变的反应条件可能为_________。
A.升高温度 B.加入NO
C.加催化剂 D.降低温度
②该反应在第18min时又达到平衡状态,此时 的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的 转化为HCOOH和
转化为HCOOH和 。已知常温下0.1mol·
。已知常温下0.1mol· 的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
-
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内按照催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g)+2CO(g)=N2(g)+2CO2(g)) △H=_______kJ·mol-1
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
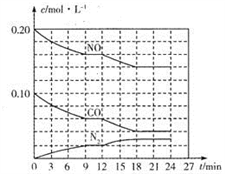
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol·L-2的
HCOONa溶液pH=10,则HCOOH的电离常数Ka=______________。
-
为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g)  2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
则2NO(g) + 2CO(g)  N2(g) + 2CO2(g)的△H=_____kJ·mol-1
N2(g) + 2CO2(g)的△H=_____kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
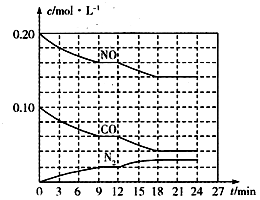
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1(保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数值为________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收,若将一定量的SO2气体通入到300mL NaOH的溶液中,再在所得溶液中逐滴加入稀盐酸至过量,产生的气体与反应的HCl两者物质的量的关系如图所示(气体的溶解和HCl的挥发忽略,NaHSO3水溶液为酸性):
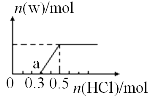
①O点溶液中所含溶质的化学式为_________________;
②a点溶液中各离子溶度大小关系为______________;
-
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器可将汽车尾气中主要污染物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
②C和CO的燃烧热(△H)分别为-393.5 kJ/mol和-283 kJ/mol
则2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=_______ kJ/mol。
(2)将 0.20 mol NO 和 0.10 mol CO充入一 个容 积 为 1L 的密闭容器中,反应过程中物质浓度变化如图所示。
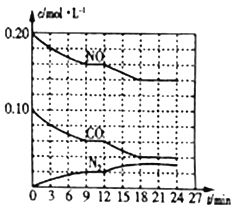
①0~9 min 内 的平均反应速率v(N2)=____mol/(L ·min) (保留两位有效数字);第12min时改变的反应条件可能为_____ (填字母).
A.升高温度 B.加入NO C.降低温度 D.加催化剂
②该反应在第24min时达到平衡状态,CO的体积分数为____(保留三位有效数字),化学平衡常数K=_______(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表可)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol/LHCOONa溶液的pH=10,则HCOOH 的电离常数Ka=_______。
=__________,反应平衡常数K=____________(保留两位有效数字)。
[Co(H2O)6]2++4C1-。甲同学向某已呈现紫色的氯化钴溶液中通入HC1,发现溶液变为________色;乙同学向溶液中加水,平衡移动方向为_______(填“向右”、“向左”或“不移动”),说明原因__________________________________。




 ∆H=180.5kJ·
∆H=180.5kJ·