-
下表是25℃时四种酸的电离平衡常数:

(1)用离子方程式表示NaNO2溶液呈碱性的原因 。
(2)25℃时,向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)︰c(CH3COO-)=5︰9,此时溶液pH= 。
(3)写出NaA溶液中通少量CO2的离子方程式 。
(4)25℃时,等物质的量浓度的HA、NaA混合溶液中,各离子浓度大小关系为 。
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2,某同学分别取少量NaCl与NaNO2与试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法 (填“可行”或“不可行”),理由是 。
-
实验室配制有0.1mol/L的Na2CO3溶液,根据电离平衡和水解知识,回答下列有关问题:
⑴写出H2CO3的电离方程式为________;
⑵Na2CO3溶液显碱性,原因是(用离子方程式表示)
________;(2分)
⑶在该溶液中,c(Na+)、c(CO32-) 、c(H+)、c(HCO3-)、c(OH-)的大小关系为
;(2分)
⑷根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)=________;(2分)
⑸根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)=________。(2分)
-
下列说法正确的是( )
A. 常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性
B. 已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强
C. 将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O)
D. 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)= c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6
-
某酸式盐NaHB的溶液在室温下呈弱碱性。下列说法正确的是
A.该盐的电离方程式为NaHB Na++H++B2-
Na++H++B2-
B.NaHB溶液中加入少量的NaOH,HB-的电离平衡常数增大
C.HB-的水解程度大于其电离程度
D.中和等物质的量的H2B和H2SO4,前者所需NaOH的量大于后者
-
下列关于盐溶液呈酸碱性的说法错误的是( )
A. 盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.  溶液呈酸性是由于溶液中
溶液呈酸性是由于溶液中
C. 在 溶液中,由水电离的
溶液中,由水电离的
D. 水电离出的 和
和 与盐中弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性
与盐中弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性
-
(6分)从 、
、 、
、 、
、 、
、 五种物质中:
五种物质中:
(1)选取溶于水中会促进水电离,且溶液显碱性的物质,用离子方程式表示溶液其显碱性的原因:
________;
(2)选取溶于水会抑制水电离,且溶液显酸性的物质,用化学用语表示其显酸性的原因:
________;
(3)选取溶于水会促进水电离,且溶液显酸性的物质,用离子方程式表示溶液其显酸性的原因:
________。
-
NaHCO3在水溶液中,HCO3-的电离程度小于HCO3-的水解程度。回答下列有关问题:
⑴H2CO3的电离方程式为________;
⑵NaHCO3溶液显碱性,原因是(用离子方程式表示)
________;
⑶在该溶液中,c(Na+)、c(H+)、c(HCO3-)、c(OH-)的大小关系为
________;
⑷根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)=________;
⑸根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)=。
-
室温下,稀氨水中存在电离平衡 ,有关叙述正确的是( )
,有关叙述正确的是( )
A.加入氯化铵固体,溶液中 减小 B.加水不断稀释,溶液碱性一定增强
减小 B.加水不断稀释,溶液碱性一定增强
C.加水稀释,平衡常数 增大 D.加入NaOH固体,平衡逆向移动
增大 D.加入NaOH固体,平衡逆向移动
-
下列有关叙述中正确的是( )
A. 常温下, 的
的 与
与 混合溶液中:
混合溶液中:
B. NaCl溶液和 溶液均显中性,两溶液中水的电离程度相同
溶液均显中性,两溶液中水的电离程度相同
C. 已知 时
时 溶液显碱性,则
溶液显碱性,则 时的电离平衡常数
时的电离平衡常数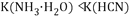
D.  醋酸溶液加少量水稀释
醋酸溶液加少量水稀释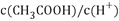 增大
增大
-
下列关于某0.1mol·L-1的CH3COOH溶液的说法,正确的是
A.在溶液中增加水的量,CH3COOH的电离平衡右移,平衡常数K增大
B.加入NaOH固体到溶液呈碱性,则整个过程溶液中水的电离程度一直增大
C.加入少量的NaOH固体,使溶液中的c(Na+)=c(CH3COO-),则溶液一定呈中性
D.加入少量的NaOH固体,使溶液的pH=7,则溶液一定呈中性

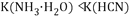
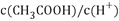 增大
增大