-
I.在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s
c/mol•L-1 | | 20 | 40 | 60 | 80 | 100 |
| N2O4 | 0.20 | a | 0.10 | c | d | e |
| NO2 | | 0.12 | b | 0.26 | 0.30 | 0.30 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)表中b______c(填“<”、“=”、“>”).0~20s内N2O4的平均反应速率为______.
(2)80℃时,该反应的平衡常数K=______.
(3)在其他条件相同时,该反应的K值越大,表明建立平衡时______.
A.N2O4的转化率越高B.NO2的产量越大
C.N2O4与NO2有浓度之比越大D.正反应进行的程度越大
(4)要增大该反应的K值,可采取的措施______.
A.增大N2O4起始浓度 B.向混合气中通入NO2
C.使用高效催化剂D.升高温度
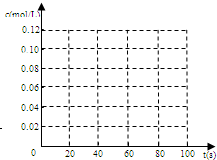
(5)如图是80℃时容器中N2O4浓度的变化图,请在该图中补画出该反应在60℃反应时N2O4浓度的变化曲线.

-
在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 。
(2)计算在 80℃时该反应的平衡常数K 。
(3)能判断该反应是否已达化学平衡状态的依据是________________。
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)= c(NO2)
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。

-
在80℃时,0.40mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
已知:N2O4 2NO2,△H>0,
2NO2,△H>0,
(1)计算20s~40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K= 。
(3)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使c(NO2)/c(N2O4)值变小,可采取的措施有(填序号) 。
A、增大N2O4的起始浓度 B、向混合气体中通入NO2
C、使用高效催化剂 D、升高温度
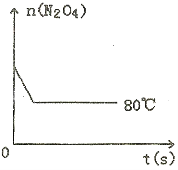
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
-
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s~40s内用N2O4表示的平均反应速率为________。
(2)计算在80℃时该反应的平衡常数K________。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号)________,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)________。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如右图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。

-
已知N2O4(无色)
 2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(S) | | 20 | 40 | 60 | 80 | 100 |
| n( N2O4 )(mol) | 0.80 | a | 0.40 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.48 | b | 1.04 | 1.20 | 1.20 |
(1)计算20s-40s内用NO2表示的平均反应速率为______,平衡时N2O4的转化率为______.
(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,则该反应的逆反应是______(填“放热”或“吸热“)
(3)该反应的平衡常数表示式为K=______要增大该反应的K值,可采取的措施有(填序号)______.
(A)向混合气体中通入NO2 (B)使用高效催化剂
(C)升高温度 (D)增大N2O4的起始浓度
(4)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在100℃时N2O4物质的量的变化曲线(反应物起始的物质的量相等).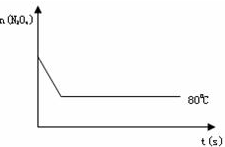
-
(6分)80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2,△H >0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H >0隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |





 (1)计算0s—20s内用N2O4表示的平均反应速率为 mol·L-1·s-1
(1)计算0s—20s内用N2O4表示的平均反应速率为 mol·L-1·s-1

 (2)要增大N2O4的转化率,同时增大该反应的K值,可采取的措施有 (填序号)
(2)要增大N2O4的转化率,同时增大该反应的K值,可采取的措施有 (填序号)
 A.通入一定量的NO2气体
A.通入一定量的NO2气体
 B.通入一定量的氦气以增大压强
B.通入一定量的氦气以增大压强
 C.使用高效催化剂
C.使用高效催化剂
 D.升高温度
D.升高温度
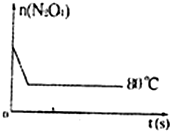
 (3)如图是80℃时容器中N2O4物质的量的变化
(3)如图是80℃时容器中N2O4物质的量的变化 曲线,请在该图中补画出该反应在60℃时
曲线,请在该图中补画出该反应在60℃时 N2O4物质的量的变化曲线。
N2O4物质的量的变化曲线。

-
(6分)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应N2O4(g) 2NO2(g) △H= +57 kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) △H= +57 kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算a =________,此温度时该反应的平衡常数K=________;
(2)改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号)________。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体
-
(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4⇌2NO2△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)
n(mol) | | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算20s~40s内用N2O4表示的平均反应速率为______ mol/
②计算在80℃时该反应的平衡常数K=______;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)______;
④要增大该反应的K值,可采取的措施有(填序号)______
A.增大N2O4的起始浓度B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度
⑤如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线______.
(2)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp).例如Cu(OH)2(S)⇌Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)•[c(OH-)]2=2×10-20当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于______;
要使0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为______.
(3)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈______性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
______.
-
(15分)在100℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,发生反应:
2NO2 N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为__________
mol/(L·s)。
(2)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是_________mol/L。假设在80s时达到平衡,请在如图中画出该条
件下N2O4和NO2的浓度随时间变化的曲线。
(3)上述(2)达到平衡后四氧化二氮的转化率为_________,混合气体的平均摩尔质量
为___________。
(4)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡将________(填“向左移动”、“向右移动”或“不移动”)。
-
在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为______mol•L-1•min-1.
(2)n3______n4(填“>”、“<”或“=”),该反应的平衡常数的值为______;
(3)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是______mol/L.
(4)假设从放入N2O4到平衡时需要80s,请在右图中画出并标明该条件下此反应中N2O4浓度随时间变化的曲线.
(5)在(4)中条件下达到平衡后四氧化二氮的转化率为______,混合气体的平均摩尔质量为______g.mol-1.
(6)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2 N2O4的平衡常数将______(填“增大”、“减小”或“不变”)
N2O4的平衡常数将______(填“增大”、“减小”或“不变”)
(7)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡2NO2 N2O4将______.(填“向左移动”、“向右移动”或“不移动”).
N2O4将______.(填“向左移动”、“向右移动”或“不移动”).
(8)达到平衡后,如果缩小容器的体积,则气体的颜色变化是先变深后变浅,但比原来的颜色深,试用平衡移动原理解释其变化的原因______.