-
催化还原CO2 是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2 和H2 可发生两个平行反应,分别生成CH3OH 和CO。反应的热化学方程式如下:
I.CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
I.CO2(g)+H2(g)  CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
某实验室控制CO2 和H2 初始投料比为1: 2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.l | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.l | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
[备注]XCat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2 中生成甲醇的百分比。
已知:①CO和H2的标准燃烧热分别为-283.0kJ/mol和一285.8kJ/mol;
②H2O(l)==H2O(g) △H3=+44.0kJ·mol-1
请回答下列问题(不考虑温度对△H的影响):
(1)反应I在_________(填“低温”或“高温”)下自发进行;反应II每生成9g水蒸气放出热量为___________。
(2)恒容条件下,有利于提高CO2 转化为CH3OH 的平衡转化率的措施有_____(填字母代号)。
A.延长反应时间 B.使用催化剂Cat.2 C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)由表中实验数据可以得出的结论是_______________________。
(4)553 K,使用催化剂Cat.2,在该时刻H2 的转化率为______(填字母代号)。
A.5.5% B.13.3% C.16.4% D.29.3%
(5)在下图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。________
(6)研究证实,CO2 也可在硫酸溶液中用情性电解生成甲醇,则生成甲醇的电极反应式是_________,另一极的电解产物为______________________。
-
催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CO2(g)+H2(g) CO(g)+H2O(g)ΔH2II
CO(g)+H2O(g)ΔH2II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
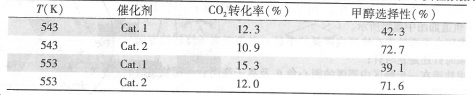
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l) H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=;反应II的ΔH2=kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是。
-
催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1 I
CO2(g)+H2(g) CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
(1)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___。
(2)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图___。

-
催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g) CO(g)+H2O(g) ΔH2 II
CO(g)+H2O(g) ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
(备注)Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=___;
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有___。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图___。

-
催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1 I
CO2(g)+H2(g)  CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1。
②H2O(l)=H2O(g) △H3=+44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=______;反应II的△H2=______kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有__________。
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________________________。
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图_________。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是_________。
-
催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1 Ⅰ
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1 Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g) ΔH2 Ⅱ
CO(g)+H2O(g) ΔH2 Ⅱ
某实验室控制CO2和H2初始投料比为1∶2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1
②H2O(l)===H2O(g) ΔH3=44.0 kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应Ⅰ的平衡常数表达式K=________;反应Ⅱ的ΔH2=________ kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有________。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是______________________________________。
(4)在图中分别画出反应Ⅰ在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图。___________________________

-
研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 反应Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g)△H2 =+41.2kJ•mol-1 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJ•mol-1 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
(1)研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式是_________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)能说明反应Ⅱ已经达到平衡状态的是_____________。
A.混合气体的平均相对分子质量不变
B.混合气体的密度不变
C.v(H2)正>v(CO)正
D.n(CO)/n(H2)不变
(4)在恒容密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。
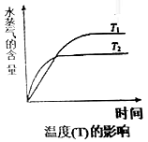
①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。则上述反应压力平衡常数KP为____________(用P0表示,并化简)。
-
催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g) CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g) CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
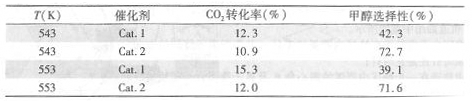
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l) H2O(g) ΔH3=44.0kJ·mol-1
H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
(4)在右图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___ 极,该电极反应式是 。
-
催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g) CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 Ⅰ
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 Ⅰ
CO2(g)+ H2(g) CO(g)+H2O(g)ΔH2 Ⅱ
CO(g)+H2O(g)ΔH2 Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
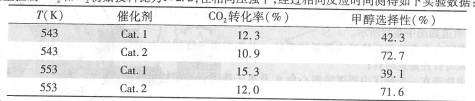
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l) H2O(g) ΔH3=44.0kJ·mol-1
H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应Ⅰ的平衡常数表达式K= ;反应Ⅱ的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
(4)在右图中分别画出Ⅰ在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在 极,该电极反应式是 。
-
研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g) △H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g) △H2 =+41.2kJ•mol-1 平衡常数K2 反应Ⅱ
CO(g)+H2O(g) △H2 =+41.2kJ•mol-1 平衡常数K2 反应Ⅱ
(1)一定条件下,将n(CO2): n(H2)=1:1的混合气体充入绝热恒容密闭容器中发生反应。下列事实可以说明反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)已达到平衡的是_______
CH3OH(g)+H2O(g)已达到平衡的是_______
A 容器内气体密度保持不变 B CO2体积分数保持不变
C 该反应的平衡常数保持不变 D 混合气体的平均相对分子质量不变
(2)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应的电极反应式是___________________。
(3)反应CO(g)+2H2(g) CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。
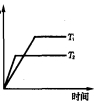
①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的物质的量
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
CH3OH(g)+H2O(g)△H1 反应Ⅰ
CO(g)+H2O(g)△H2 =+41.2kJ•mol-1 反应Ⅱ











