-
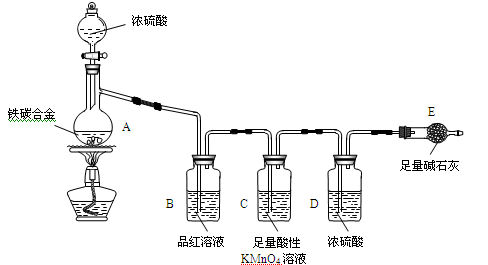
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题。
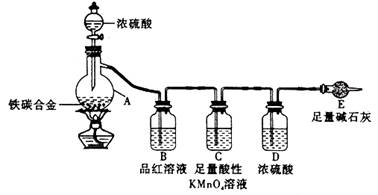
Ⅰ 探究浓硫酸的某些性质
(1)按图示连接装置,检查装置的气密性,称量E的质量。
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为____________,
未点燃酒精灯前,A、B均无明显现象,其原因是:_______________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显现象。
A中开始发生反应的化学方程式为:2Fe +6H2SO4  Fe2(SO4)3 + 3SO2↑ +6H2O
Fe2(SO4)3 + 3SO2↑ +6H2O
和______________________________________ (写化学方程式)。
B中的现象是_________,由此可得到浓硫酸具有_______性,C装置的作用________。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式__ __。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式),为使实验数据更为精确,可在装有碱石灰的干燥管后加入________________________________。
-
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
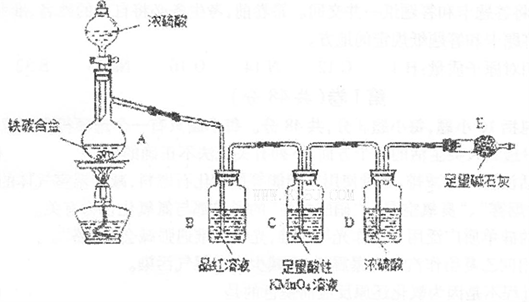
I.测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根
导管,然后________________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。铁碳合金中铁的质量分数为_____________________________________________(写表达式)。
(3)装置C中反应的离子方程式为________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是____________________________________.
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分
数也可能会偏离。你认为其中的原因是_________________________________________。
Ⅱ.探究浓硫酸的某些性质:
(6)往A中滴加足量的滚硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
_____________________________________________________________________。
(7)将A中固体换为金属铜则与浓硫酸发生反应的化学方程式是__________________
_______________________,反应中浓硫酸表现出的性质是______________________。
-
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
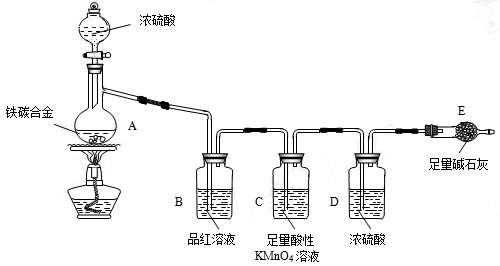
I 测定铁的质量分数:(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后_____________________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为______________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、水蒸气进入E管使b增大。你认为改进的方法是_______________________。
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高。你认为其中的原因是__________________________________________。
Ⅱ 探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:_______________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_________________________________。
-
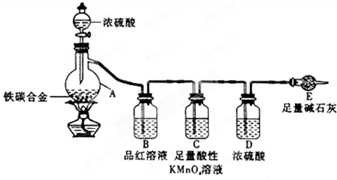
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.
Ⅰ探究浓硫酸的某些性质
(1)按图示连接装置,检查装置的气密性,称量E的质量.
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸.仪器A的名称为______,
未点燃酒精灯前,A、B均无明显现象,其原因是:______.
(3)点燃酒精灯一段时间后,A、B中可观察到明显现象.
A中开始发生反应的化学方程式为:2Fe+6H2SO4  Fe2(SO4)3+3SO2↑+6H2O和______ CO2↑+2SO2↑+2H2O
Fe2(SO4)3+3SO2↑+6H2O和______ CO2↑+2SO2↑+2H2O
-
(10分)某化学兴趣小组为了测定铁碳合金(铁和碳两种单质的混合物)中铁的质量分数,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后______________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,加热,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为_________________(写表达式)。
(3)装置C的作用______________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、水蒸气进入E管使b增大。你认为改进的方法是 。
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高。你认为其中的原因是 。
-
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。

(1)按图示的连接装置,检查装置的气密性并称量E的质量。将10克铁碳合金样品放入A中,再加入适量的浓硫酸,仪器A的名称为_________________。未点燃酒精灯前,A、B均无明显现象 。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。写出A中浓硫酸参与反应的化学方程式 __________________(任写一个)。C装置的作用是 _____________ 。
(3)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重1.1克。则铁碳合金中铁的质量分数为 _________________ 。
(5)该装置存在一些缺陷,使得测定结果可能会产生误差,请指出该装置的缺陷__________ 、 __________________________
-
某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。

(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应;② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)C装置的作用 。
(4)该小组同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能会导致铁质量分数测量值偏低的是 。
A.A中反应不完全
B.E中碱石灰会吸收空气中的CO2和H2O
C.反应生成的SO2部分被E中碱石灰吸收
D.反应完全后,还有CO2气体滞留在装置体系中
-
某兴趣小组在实验室用加热乙醇、浓硫酸、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物和探究溴乙烷的性质。
(一)溴乙烷的制备及产物的检验:设计了下图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤,回答下列问题:
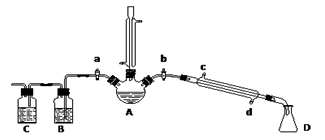
(1)仪器A中除了加入上述物质外,还需加入________。
(2)上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等
①检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验.B、C中应盛放的试剂分别是________、________(填写字母)
a.苯 b.水 c.NaOH溶液 d.硝酸银溶液
②检验副产物中是否含有乙醚:通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,来确定副产物中存在乙醚.该同学的方案________(选填“正确”或“不正确”),理由是________________;
(3)欲除去溴乙烷中的少量杂质Br2,正确方法是___________;(填字母)
a.用KI溶液洗涤 b.用水洗涤 c.用CCl4萃取 d.用亚硫酸钠溶液洗涤
(二)溴乙烷性质的探究:某同学用右下图装置(铁架台、酒精灯等未画出)来探究溴乙烷的性质(已知NaBr+H2SO4(浓) NaHSO4+HBr↑)。
NaHSO4+HBr↑)。
(1)在试管中加入10mL6mol/L NaOH水溶液和5mL 溴乙烷,水浴加热,当观察到___________现象时,表明溴乙烷与NaOH水溶液已完全反应,该反应的化学方程式为______________;
(2)在试管中加入10mL饱和NaOH乙醇溶液和5mL 溴乙烷,水浴加热,为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,需要检验的是______________。
-
为测定某生铁(假设仅含Fe和C)粉末状样品中铁的质量分数,某化学研究性学习小组设计有关方案进行如下实验。
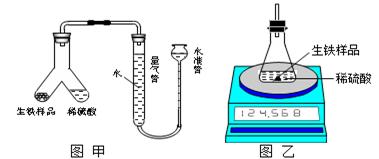
(1)设计如图甲所示装置,使生铁样品与稀硫酸反应的操作为________。
实验结束后,读出量气管中的气体体积(换算为标准状况),计算生铁样品中铁的质量分数,测定的结果偏低,可能的原因是________。(填字母序号)
A. 反应结束并冷却后,未再次调节量气管和水准管中液面相平, 即读取气体体积
B. 稀硫酸过量
C. 水准管中有少量水溢出
(2)设计如图乙所示装置,测得反应前后的有关质量如表,则生铁样品中铁的质量分数为________,根据图中装置判断,若实验中操作没有失误,该实验结果可能________ 。(填“偏大”、“偏小”或 “准确”)
| 反应前:整套装置+ 稀硫酸质量/g | 反应前: 生铁样品质量/g | 反应后:整套装置+ 锥形瓶中剩余物的质量/g |
| a | m | b |
(3)若取生铁粉末5.72 g,高温下的氧气流中充分反应,得到CO2气体224 mL(标准状况)。则此生铁粉末中铁和碳的物质的量之比为________。若再取三份不同质量的生铁粉末,分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示。计算实验Ⅱ结束后的溶液中,还能溶解生铁样品的质量________。
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入生铁样品的质量/g | 1.43 | 2.86 | 8.58 |
| 生成气体的体积/L(标准状况) | 0.56 | 1.12 | 2.24 |
-
某化学兴趣小组为探究氯气的性质并用Cl2制备HClO,设计如下实验方案,请回答下列问题:
实验一:性质探究
设计图3实验装置来制备并验证氯气的性质,部分夹持设计未画出。
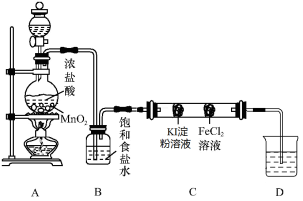
图3
(1)请写出装置A中制备氯气的反应化学方程式______________________;
(2)装置B的作用是______________________;
(3)双通管C中事先装有两个沾有相关试剂的棉球,实验现象为_____________;
实验二:制备HClO
(4)设计图4所示装置E代替图3中的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。
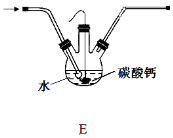
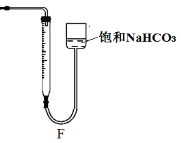
图4
①该方案反应后所得的溶液中HClO浓度比氯水中大的原因是_______________
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除CaCl2、HClO外,还含有__________
③该小组同学测得反应中碳酸钙质量减少a g,反应后从所得的100mL溶液中取用10mL与稀盐酸混合,连接F装置测得产生的气体体积为b L(已换算成标准状况),则原溶液中CaCl2的浓度为 mol·L-1(用含a、b的代数式表示,可不必化简)。

Fe2(SO4)3 + 3SO2↑ +6H2O










