-
为了证明化学反应有一定的限度,进行了如下探究活动:
(1)步骤1:取8mL0.1mol•L﹣1的KI溶液于试管,滴加0.1mol•L﹣1的FeCl3溶液5~6滴,振荡;请写出步骤1中发生的离子反应方程式:_____________________。
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加5~6滴0.1mol•L﹣1____________________(试剂名称),振荡,未见溶液呈血红色。
(2)探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色
为了验证猜想,在查阅资料后,获得下列信息:
信息一:Fe3+可与[Fe(CN)6]4﹣反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
信息二:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
结合新信息,请你完成以下实验:各取少许步骤3的水溶液分别于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
| 实验操作 | 预期现象 | 结论 |
| 实验1:①__________________________________ | 蓝色沉淀 | ②_______________ |
| 实验2:在试管B加入少量乙醚,充分振荡,静置 | ③______________ | 则“猜想二”成立 |
-
为了证明化学反应有一定的限度,进行了如下探究活动:
步骤1:取8mL0.1 的KI溶液于试管,滴加0.1
的KI溶液于试管,滴加0.1 的FeCl3溶液5~6滴,振荡;
的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:_________________
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1 的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
信息二:Fe3+可与 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
| 实验操作 | 预期现象 | 结论 |
| 实验1:在试管A加入少量乙醚,充分振荡,静置 | _________________ | ________________ |
| 实验2:__________________________ __________________________________ | 若产生蓝色沉淀 | 则“猜想二”成立 |
-
为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL0.1mol/L的KI溶液,滴加5至6滴FeCl3稀溶液;
Ⅱ.继续加入2mLCCl4振荡;
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为____________,探究活动Ⅱ的实验现象为_______________。
(2)为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取20.00mLFeCl3稀溶液至锥形瓶中,加入___________用作指示剂,再用c mol/LKI标准溶液进行滴定,达到滴定终点时的现象是__________________________________________。
②重复滴定三次,平均耗用cmol/LKI标准溶液VmL,则FeCl3溶液物质的量浓度为_________mol/L。
③若滴定前滴定管尖嘴中无气泡,滴定后有气泡,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅳ.探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+ 猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察,为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4—反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息,现设计以下实验方案验证猜想:
①完成下表
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后的上层清液滴加______________ | 若___________________________,则猜想一不成立。 |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若____________________________,则猜想二成立。 |
②写出实验操作“步骤一”中的反应离子方程式:_____________________________________。
-
为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL0.1mol/L的KI溶液,滴加5至6滴FeCl3稀溶液;
Ⅱ.继续加入2mLCCl4振荡;
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为____________,探究活动Ⅱ的实验现象为_______________。
(2)为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取20.00mLFeCl3稀溶液至锥形瓶中,加入___________用作指示剂,再用c mol/LKI标准溶液进行滴定,达到滴定终点时的现象是__________________________________________。
②重复滴定三次,平均耗用cmol/LKI标准溶液VmL,则FeCl3溶液物质的量浓度为_________mol/L。
③若滴定前滴定管尖嘴中无气泡,滴定后有气泡,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅳ.探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+ 猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察,为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4—反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息,现设计以下实验方案验证猜想:
①完成下表
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后的上层清液滴加______________ | 若___________________________,则猜想一不成立。 |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若____________________________,则猜想二成立。 |
②写出实验操作“步骤一”中的反应离子方程式:_____________________________________。
-
某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL 0.1mol/L KI溶液于试管中,滴加0.1mol/L FeCl3溶液2mL,发生如下反应:2Fe3++2I- 2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验中①不合理,你认为是_____________________________;在不改变反应物用量的前提下,改进的方法是_____________________________________________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是______________________________。
(3)控制适合的条件,将反应2Fe3++2I- 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。
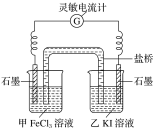
①反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为_________________________。
②电流计读数为0时,反应达到平衡状态。此时在甲中加入FeCl2固体,发现电流计又发生偏转,则甲中的石墨作_______(填“正”或“负”)极,该电极的电极反应式为_________________________。
-
为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5 mL 0.5 mol•L-1 KI溶液,滴加0.1 mol•L-1 FeCl3溶液5~6滴,充分反应。下列实验操作能验证该反应是否存在限度的是
A. 再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
B. 再滴加AgNO3溶液,观察是否有黄色沉淀产生
C. 再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变血红色
D. 再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察有否白色沉淀产生
-
对FeCl3溶液与KI溶液的反应进行探究。关于实验的分析和结论不正确的是
| 实验操作 | 实验现象 |
| 1 | 取 2mL0.1mol/L KI 溶液于试管中,滴加0.1mol/L FeCl3溶液 3 滴,振荡,充分反应 | 溶液呈深棕黄色 |
| 2 | 将溶液均分后置于试管 1 和试管 2 中 | |
| 向试管 1 中滴加 2 滴 0.1mol/L KSCN 溶液 | 溶液显红色 |
| 向试管 2 中加入1mL CCl4,充分振荡、静置 | 溶液分层,上层为浅棕黄色,下层为紫色 |
| ③ | 取试管 2 的上层液体置于试管 3 中,滴加 2滴 0.1mol/L KSCN 溶液 | 溶液微弱变红 |
A.FeCl3 与 KI 发生了氧化还原反应,有I2生成
B.试管 1 中溶液显红色证明FeCl3与 KI 的反应具有可逆性
C.试管 2 中上层溶液变为浅棕黄色是平衡移动的结果
D.试管 3 中红色比试管 1 中浅是平衡移动的结果
-
已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
| 实验 1 | 实验步骤 | 实验现象 |
| ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ. 溶液呈棕黄色。 |
| ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液不显红色。 |
① 写出FeCl3溶液与KI溶液反应的离子方程式_______________________。
② 加入KSCN溶液的目的是_______________________________________。
③ 甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,改进实验方案,进行实验2。
| 实验2 | 实验步骤 | 实验现象 |
| ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ. 溶液呈棕黄色。 |
| ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液显红色。 |
| ⅲ. 继续加入2 mL CCl4,充分振荡、静置。 | ⅲ. 液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是_________________________________________。
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因________________。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I- I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
① 为验证假设,乙同学设计并完成了实验3。
| 实验3 | 实验步骤 | 实验现象 |
| ⅰ. 取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ. 液体分层,上层呈黄色,下层呈紫红色。 |
| ⅱ. 取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ. 液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是_________________________________。
② 甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I- I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中_________________。两支试管中的现象分别为__________________________________。
-
某化学课外活动小组探究淀粉水解的条件,进行以下两个实验。
(1)实验用品:0.5 g淀粉、4 mL 20%硫酸溶液、氢氧化钠溶液、银氨溶液、碘水。
步骤:在试管1和试管2里各放入0.5 g淀粉,在试管1里加入4 mL 20%硫酸溶液,在试管2里加入4 mL水,都加热3~4 min。用过量碱液中和试管1里的硫酸溶液,把一部分液体倒入试管3。在试管2、3里都加入碘水,观察有没有蓝色出现。在试管1里加入银氨溶液,稍加热后,观察试管内壁上有无银镜出现。
根据所学知识预测可能的实验现象。
实验现象与结论(填入下表):
| 试管 | 加入碘水 | 加入银氨溶液 | 结论 |
| 1 | __________ | __________ | __________ |
| 2 | __________ | __________ | __________ |
| 3 | __________ | __________ | __________ |
(2)实验用品:0.5 g淀粉、唾液、新制氢氧化铜悬浊液。
步骤:在试管中加入0.5 g淀粉,加入少许唾液加热,在水解液中加入新制氢氧化铜悬浊液加热煮沸,观察现象。
现象:__________________________________________。
结论:__________________________________________。
(3)比较实验(1) (2)可得出的结论:___________________。
-
某班在实验室进行制取乙酸乙酯并对其性质进行探究的分组实验,主要步骤如下:
I.为探究乙酸乙酯的水解反应,某组同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
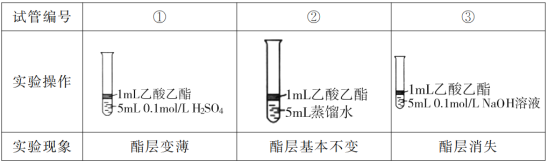
(1)设计实验①和②,是为了探究___对乙酸乙酯的水解的影响。
(2)试管③中反应的化学方程式是__。
Ⅱ.某组同学为验证醋酸、碳酸与苯酚三者酸性的强弱,经过慎重考虑,设计如下实验装置。已知A中装有醋酸,D中装有苯酚钠,请回答问题:
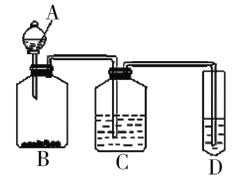
(1)C所盛放的药品是___,装置C的作用___。
(2)试描述能证明三种酸的酸性强弱的实验现象___。
的KI溶液于试管,滴加0.1
的FeCl3溶液5~6滴,振荡;
的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。


