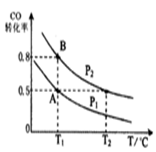
-
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析。具体步骤如图所示:
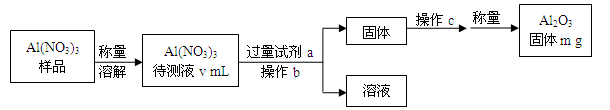
①加入过量氨水后发生反应的离子方程式为:___________________________。
②操作b为:________________。
③Al(NO3)3待测液中,c(Al3+)=___________ mol/L(用含m、V的代数式表示)。
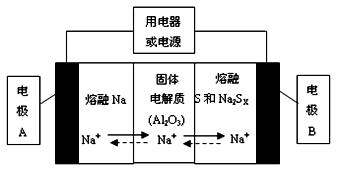
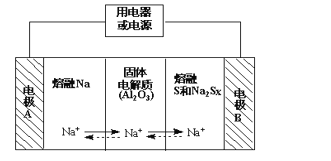
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050、 |
| 沸点/℃ | 892 | 444.6 | 2980 |
①根据上右表数据,请你判断该电池工作的适宜应控制在____________(填字母)范围内。
A.100℃以下 B.100~300℃ C.300~350℃ D.350~2050℃
②放电时,电极A为_________极,电极B发生_________反应(填“氧化或还原”)
③充电时,总反应为Na2SX=2Na+xS(3<x<5),则阳极的电极反应式为:________________。
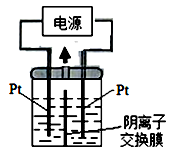
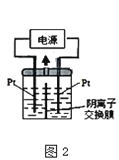
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:________________;试分析左侧溶液蓝色逐渐变浅的可能原因是:_____________________。
-
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
(1)根据表数据,请你判断该电池工作的适宜应控制在_____(填字母)范围内。
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100~300℃
C.300~350℃ D.350~2050℃
(2)放电时,电极A为___极,电极B发生_____反应(填“氧化或还原”)。
(3)充电时,总反应为Na2Sx=2Na+xS,则阳极的电极反应式为:_______。
(4)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如(如图)所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:___;试分析左侧溶液蓝色逐渐变浅的可能原因是:___。

-
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
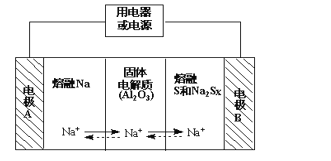
(1)根据表数据,请你判断该电池工作的适宜应控制在_____(填字母)范围内。
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100~300℃
C.300~350℃ D.350~2050℃
(2)放电时,电极A为___极,电极B发生_____反应(填“氧化或还原”)。
(3)充电时,总反应为Na2Sx=2Na+xS,则阳极的电极反应式为:_______。
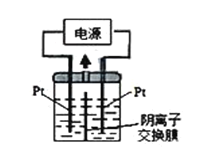
(4)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如(如图)所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:___;试分析左侧溶液蓝色逐渐变浅的可能原因是:___。
-
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示:
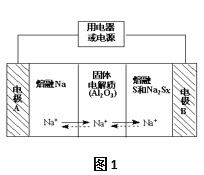
(1)根据表数据,请你判断该电池工作的适宜应控制
在_____(填字母)范围内。
A.100℃以下 B.100~300℃
C.300~350℃ D.350~2050℃
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
(2)放电时,电极A为_____极,电极B发生_____反应(填“氧化或还原”)。
(3)充电时,总反应为Na2Sx=2Na+xS,则阳极的电极反应式为:________________。
(4)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:________________;试分析左侧溶液蓝色逐渐变浅的可能原因是:___________________。
-
新型电池在飞速发展的信息技术中发挥着越来越重要的作用。
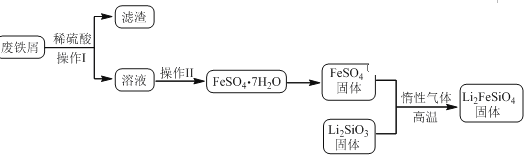
Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4=Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
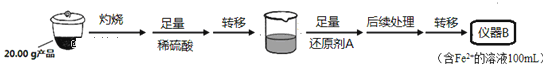
从仪器B中取20.00mL溶液至锥形瓶中,另取0.20mol•L-1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 22.40mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B____,仪器C____。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是____。
(3)在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需____;
(4)操作Ⅱ的步骤是:__、__、过滤、洗涤。
(5)还原剂A可用SO2,写出该反应的离子方程式____,此时后续处理的主要目的是____。
(6)滴定终点时现象为____;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为____;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量____(填“偏高”、“偏低”或“不变”)。
-
甲醇是一种重要的化工原料,在化工领域有广泛应用。
(1)甲醇燃料电池由于结构简单、能量转化率高、对环境天污染,可作为常规能源的替代品而越来越受到关注。其工作原理如如图所示:
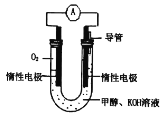
①该电池正极的电极反应为___,放电过程中负极区域溶液的pH值___(填“变大”或“变小”或“不变”)。
②该电池总反应的化学方程式为___。
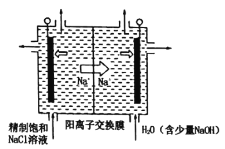
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高校、光谱、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
①如图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为___mol。
(3)英国《自然》杂志近期报道了一种新型铝离子电池,以金属铝和石墨为电极,用A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。
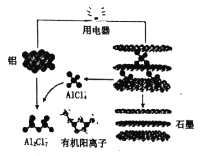
①电池放电时负极的电极反应式为___。
②充电时有机阳离子向___电极移动(填“铝”或“石墨”)。
③电池充电时,电路中每转移0.15mol电子,理论上生成___g铝。
-
高氯酸在化工生产中有广泛应用,工业上以NaClO4为原料制备高氯酸的原理如图所示.下列说法正确的是
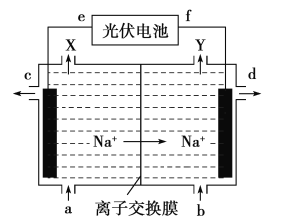
A.上述装置中,f极为光伏电池的正极
B.阴极的电极反应为2H2O-4e- =4H++O2↑
C.d处得到较浓的NaOH 溶液,c处得到HClO4
D.若转移2mol电子,理论上生成100.5gHClO4
-
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料有许多优点,但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:________________________________。
(2)氢气可用于制备H2O2。
已知:H2(g)+A(l)===B(l) ΔH1
O2(g)+B(l)===A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)===H2O2(l)的ΔH________0(填“>”“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)  MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
-
近年来有多个品牌的手机电池曾发生爆炸事故,公众对电池安全性的重视程度越来越高,燃料电池作为安全性能较好的一类化学电源得到了更快的发展。 一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法不正确的是( )
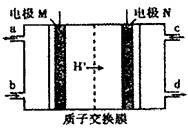
A. M极生成氮气且电极附近pH降低
B. 负极上每消耗1molN2H4,会有4molH+通过质子交换膜
C. 正极的电极反应式为:O2+4H++4e-=2H2O
D. d口流出的液体是蒸馏水
-
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
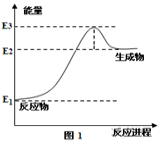
(2)以甲烷为原料可制得氢气。图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量(KJ)变化示意图,写出该反应的热化学方程式_______________(△H用E1、E2、E3表示)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
A.容器内气体压强保持不变
B.吸收y mol H2只需1 mol MHx
C. 若降温,该反应的平衡常数
若降温,该反应的平衡常数 增大
增大
D.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH- FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
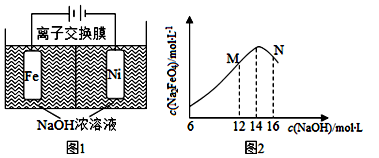
①电解一段时间后,c(OH-)降低的区域在__________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_____________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(  Na2FeO4)低于最高值的原因:_____________。
Na2FeO4)低于最高值的原因:_____________。
(5)在容积可变的密闭容器中充入10molCO和20molH2,发生CO ( g ) + 2H2 ( g ) CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L。
CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L。