-
近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:

回答下列问题:
(1)进入分解池中主要物质是______;在合成塔中,若足量的H2与CO2反应,消耗4.4gCO2,生成气态的H2O和CH3OH,可放出5370J的热量,写出该反应的热化学方程式________。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”: ①_______;②_______。
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示:

①催化剂效果最佳的是_______(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)______v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。c点时该反应的平衡常数K=___________(保留一位小数)。
(4)科学家还研究了利用温室气体制造充电电池,下图为正在研究的Na—CO2可充电电池示意图,该装置放电时的总反应方程式为_________。

(5)己知25℃时H2CO3的电离平衡常数为:Kal =4.4×10-7、Ka2 =4.7×l0-ll,则反应:HCO3-+H2O H2CO3+ OH-的平衡常数K=________。
H2CO3+ OH-的平衡常数K=________。
-
近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:

回答下列问题:
(1)进入分解池中主要物质是______;在合成塔中,若有4.4kgCO2与足量H2反应,生成气态的H2O和CH3OH,可放出5370kJ的热量,写出该反应的热化学方程式:____________。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”:①____________;②________。
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0 mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如下图所示:

①催化剂效果最佳的是_______(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)______v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___________。c点时该反应的平衡常数K=___________。
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时的总反应方程式为_________________。

(5)己知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×l0-ll,则反应:HCO3- +H2O H2CO3+ OH-的平衡常数K=________。
H2CO3+ OH-的平衡常数K=________。
-
近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:

回答下列问题:
(1)进入分解池中主要物质是______;在合成塔中,若有4.4kgCO2与足量H2反应,生成气态的H2O和CH3OH,可放出5370kJ的热量,写出该反应的热化学方程式:____________。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”:①____________;②________。
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0 mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如下图所示:

①催化剂效果最佳的是_______(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)______v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___________。c点时该反应的平衡常数K=___________。
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时的总反应方程式为_________________。

(5)己知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×l0-ll,则反应:HCO3- +H2O H2CO3+ OH-的平衡常数K=________。
H2CO3+ OH-的平衡常数K=________。
-
近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
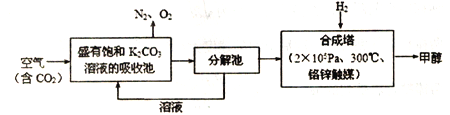
(1) 已知:CO(g)+2H2(g) CH3OH(g) ΔH1=-94.9kJ/mol
CH3OH(g) ΔH1=-94.9kJ/mol
CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
则在合成塔中,CO2与H2反应生成气态的H2O和甲醇的热化学方程式为_________.
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”( 写出一条即可)________.
(3)一定条件下,往2L 恒容密闭容器中充入1mol CO2 和3 mol H2,在不同催化剂作用下发生反应I、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如下图所示:

①催化剂效果最佳的反应是__________(填“反应I”,“反应Ⅱ”,“反应Ⅲ”)。
②b点v (正)______ v (逆)(填“>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。
④c点时该反应的平衡常数K =________。
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为__________。

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5mo/L,则生成沉淀所 需CaCl2溶液的最小浓度为________。
-
近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400 g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________。
(3)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”_______________。
(4)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________。
④c点时该反应的平衡常数K =____________________。
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________。

-
近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_______________。(填化学式)
(2)在合成塔中,若有4400g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,该反应的热化学方程式为_______________________________________。
(3)该工艺体现了“绿色自由”构想的“绿色”理念的方面有_______________________(任答一条)。
(4)一定条件下,往2 L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是_________(填“反应I”、“反应II”、“反应III”)。同一种催化剂,温度越高,催化效果____(填“不变”、“增强”、“减弱”),分析其原因可能是_________(填字母)。
A.温度升高,平衡逆向移动 B.温度升高,催化剂失活
C.温度升高,催化剂脱附率增加 D.温度升高,平衡常数减小
②b点v(正)______v(逆)(填“>”、“<”或“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是__________。
④c点时该反应的平衡常数K=______。
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为___________________________,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为________mol。

-
近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400 g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________。
(3)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”_______________。
(4)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________。
④c点时该反应的平衡常数K =____________________。
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________。

-
近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400 g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________。
(3)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”_______________。
(4)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________。
④c点时该反应的平衡常数K =____________________。
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________。

-
近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
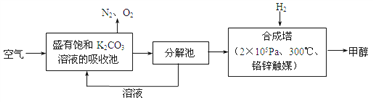
(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400 g CO2与足量H2完全反应,生成气态的H2O和气态甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________。
(3)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________。
④c点时该反应的平衡常数K =____________________。
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________。

-
近年科学家提出“绿色自由”构想。把含有CO2的空气吹入K2CO3溶被中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示,下列有关说法不正确的是
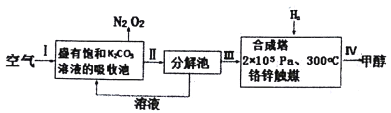
A. I、II两步目的是为了富集CO2
B. 从合成塔中及时分离出甲醇可以提高CO2的转化率
C. 过程中K2CO3可以循环使用
D. 铬锌触媒催化剂可以改变合成甲醇的焓变



H2CO3+ OH-的平衡常数K=________。
























