-
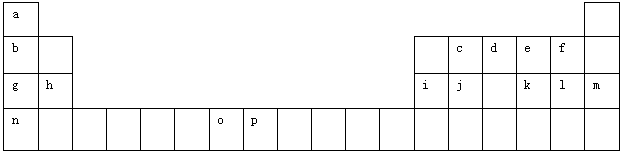
(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)元素p的原子的电子占有 种能量不同的原子轨道。
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为 (用离子符号表示)。
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为______________,该分子是______(填“极性”或“非极性”)分子。
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____________。
(5)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 |
| I3 | 3248 | 2957 |
| | | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____________________________________________________;
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为 ,含有的化学键为 。
-
下表是元素周期表的一部分.表中所列字母分别代表一种元素.
试回答下列问题:
(1)请画出元素D的基态原子的价电子排布图______________;与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有______________种;
(2)A的最简单氢化物的中心原子的杂化形式为______________;C在空气中燃烧产物的分子构型为______________,与其互为等电子体的单质的分子式为______________;
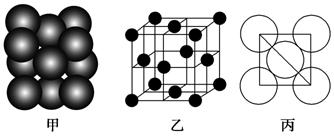
(3)B单质晶体中原子的堆积方式如图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
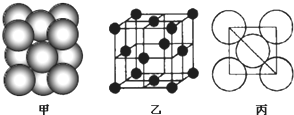
①晶胞中B原子的配位数为______________,其堆积方式______________(填“是或否”)密置堆积。②若B原子的半径为d cm,用NA表示阿伏加德罗常数,M表示B原子的相对原子质量,则该晶体的密度为______________(用字母表示)。
-
如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.试回答下列问题:
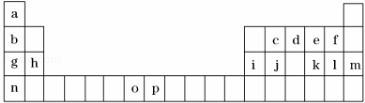
(1)元素o为25号元素,请写出其基态原子的电子排布式______.
(2)d与a反应的产物的分子中,中心原子的杂化形式为______.
(3)d、e、f三种元素的电负性大小顺序为(用元素符号表示)_________________.
(4)o、p两元素的部分电离能数据列于下表:

比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是______.
-
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
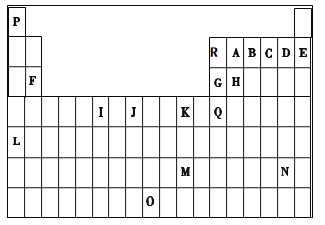
试回答下列问题:
(1)I的最高化合价为__________,J价电子排布图__________。
(2)写出基态时G元素原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为____________ 。
(3)第一电离能介于R、B之间的第二周期元素有_____________种。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)配合物甲的焰色反应呈紫色,其内界由中心离子J3+与配位体AB-构成,配位数为6,甲的水溶液可用于实验室J2+的定性检验,此方法检验J2+的离子方程式为_____________________。
(6)写出Q元素的简写电子排布式___________________________________。
-
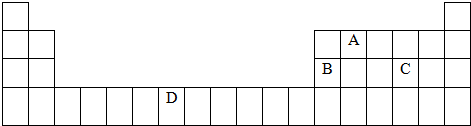
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
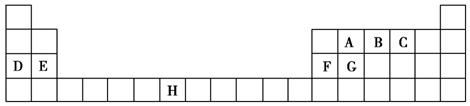
试回答下列问题:
(1)B、D、F、G的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)请写出元素H的基态原子电子排布式_____________________。
(3)A的最简单氢化物分子里中心原子采取________形式杂化,A的最高价氧化物分子的空间构型是________。
(4)D的氯化物的熔点比G的氯化物的熔点________(填“高”或“低”),理由是__________________________。
(5)元素C与元素G形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。晶胞中F原子的配位数为________,一个晶胞中F原子的数目为________。
-
(物质结构与性质)
Ⅰ.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素D的基态原子电子排布式___________________。
(2)元素A、B形成的单质中,______对应的单质熔点更高,原因是_________________。
(3)写出C的最高价氧化物的水化物与B的最高价氧化物的水化物反应的化学方程式_______________。
(4)元素D可以形成化学式为D(NH3)5BrSO4,配位数均为6的两种配合物。若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为____________。
Ⅱ.钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价。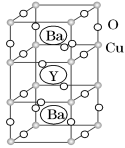
(5)根据图示晶胞结构,推算晶体中Y,Ba,Cu和O原子个数比,确定其化学式为________。
Ⅲ.BF3与一定量的水形成晶体Q [(H2O)2·BF3],Q在一定条件下可转化为R: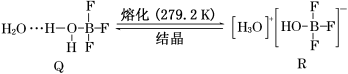
(6)晶体Q中各种微粒间的作用力不涉及________(填字母)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
(7)R中阳离子的空间构型为________,阴离子的中心原子轨道采用_____杂化。
-
如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)请写出元素O的基态原子电子排布式 .
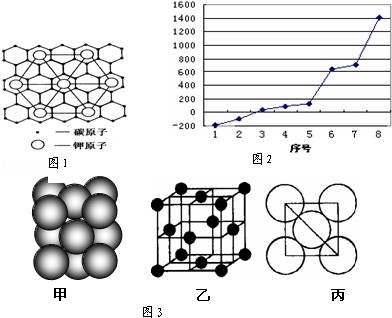
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图1,则x值为 .
(3)第三周期8种元素按单质熔点高低的顺序如图2,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号).
(4)由i原子跟d原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为 ,d原子的杂化类型为 .
(5)i单质晶体中原子的堆积方式如图3甲所示,其晶胞特征如图3乙所示,原子之间相互位置关系的平面图如图3丙所示.若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,则该晶体的密度为 g/cm3(用字母表示).
-
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)写出元素e的基态原子电子排布式________________,其未成对电子数为________。
(2)c在空气中燃烧产物的分子构型为_____,中心原子的杂化形式为______杂化。c能形成一种八元环状形同王冠的单质分子,原子的杂化形式为______杂化。
(3)b单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
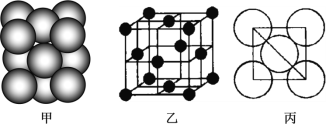
若已知b的原子半径为d厘米,NA代表阿伏加德罗常数,b的相对原子质量为M,请回答:
①晶胞中b原子的配位数为_____,表示原子空间占有率的代数式为_____________。
②该晶体的密度为_____________g/cm3(用含有关字母的代数式表示)。a、f中,与单质b晶体中原子的堆积方式相同的是__________(填元素符号)。
-
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
| 元 素 | O | P |
| 电离能
kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 |
| I3 | 3248 | 2957 |
| | | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;
-
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
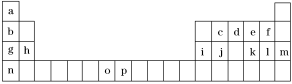
(1)元素p为26号元素,请写出其基态原子的外围电子排布式________________。
(2)e与a反应产物的分子中,中心原子的杂化形式为________________________。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p |
| 电离能 /kJ·mol-1 | I1[ | 717 | 759 |
| I2 | 1 509 | 1 561 |
| I3 | 3 248 | 2 957 |
| | | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是________________________________________________________________
________________________________________________________________________。
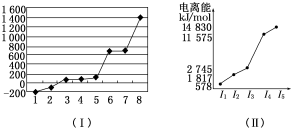
(5)第三周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是________(填下图中的序号)。
(6)表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是________(填元素符号)。