-
生活中常使用的铝合金中的铝来自于电解熔融氧化铝.用于工业电解的氧化铝要求其纯度不得低于98.2%,而天然铝土矿中的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下所示:

一些难溶物开始沉淀和完全沉淀的pH如表所示:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度为0.01mol、L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝与盐酸发生反应的离子方程式为______.
(2)步骤②③④中操作的名称为______.
(3)固体A的化学式为______;物质C的化学式为______:溶液中的Na+、Ca2+、Mg2+是在步骤______中除去的.
(4)步骤③中调节溶液pH的数值范围为______,步骤④中调节溶液pH的数值范围为______.
(5)步骤⑥中发生反应的化学方程式为______冰晶石4Al+3O2↑
-
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下。

一些氢氧化物沉淀的pH如下表。
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题。
(1)实验室进行步骤④的操作名称为________。
(2)固体A的化学式为________,物质C的化学式为________。
(3)步骤④调节pH的范围为________。
(4)步骤⑥反应的化学方程式为________。
-
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:

一些氢氧化物沉淀的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为________________。
(2)实验室进行步骤②③④的操作名称为________。
(3)固体A的化学式为________,物质C的化学式为________;溶液中的Na+、Ca2+、Mg2+是在步骤________中分离出去的。
(4)步骤③调节pH的数值范围为________,步骤④调节pH的数值范围为________。
(5)步骤⑥反应的化学方程式为________。
-
(10分)工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:

请回答下列问题:
(1)沉淀C的化学式为________,该物质除了用于金属冶炼以外,还可用作________。
(2)电解熔融的氧化铝时,若得到标准状况下22.4 L O2,则同时生成________g铝。
(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是________(填操作名称),实验室要洗涤Al(OH)3沉淀应该在________装置中进行,洗涤方法是______________________________________
________________________________________________________________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
(5)写出Na2CO3溶液与CaO反应的离子方程式:________________________________。
(6)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:________(填化学式)。
-
下列说法不正确的是

A.工业上利用电解熔融氯化钠的方法来制备金属钠
B.可用丁达尔效应区分胶体和溶液
C.工业上利用焦炭与二氧化硅在高温下反应可直接制得高纯度的硅
D.医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂
-
化学与人类生活、生产和社会可持续发展密切相关。下列说法正确的是( )
A. 铝及其合金是使用广泛的金属材料,通常用电解氯化铝的方法制备铝
B. 为测定熔融氢氧化钠的导电性,常将氢氧化钠固体放在石英坩埚中加热熔化
C. 采取“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法,可提高空气质量
D. 氰化物泄漏时,可直接将其冲入下水道,让其自然消解
-
(12分)【化学—化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。

(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________,下列可作阴极材料的是______。
a.铝材 b.石墨 c.铅板 d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
-
下列制备符合工业生产实际的是
A. 用电解熔融氯化镁制单质镁
B. 用电解熔融氯化铝制单质铝
C. 用电解饱和食盐水制氯气
D. 用二氧化硅与焦炭在高温下反应制得高纯度的硅
-
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3  4Al+3O2↑加入冰晶石的作用:_______________________________。
4Al+3O2↑加入冰晶石的作用:_______________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是________________。
A.铝材 B.石墨 C.铅板 D.纯铝
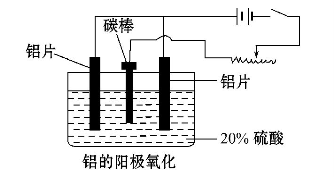
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是____________ 。
(5)下列说法正确的是 。
A. 阳极氧化是应用原电池原理进行金属材料表面处理的技术
B. 铝的阳极氧化可增强铝表面的绝缘性能
C. 铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D. 铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
-
(15分)用磷灰石制磷肥的副产品六氟硅酸钠(Na2SiF6)可制冰晶石(Na3AlF6),冰晶石是电解铝的助熔剂,可降低氧化铝的熔点。下图是工业制铝的流程图:
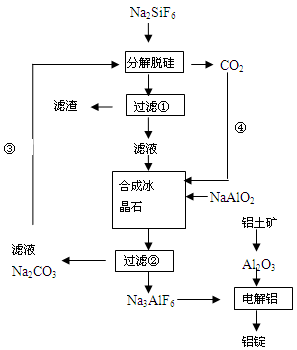
(1)工业上从铝土矿制备较高纯度Al2O3的主要工艺流程需__________个环节,第一步反应的方程式______________________________________________________________
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是________溶液,滤渣是________ 。
(3)分解脱硅和合成冰晶石化学反应方程式分别为:_________________、____________________。
(4)工艺过程中③和④的目的是_____________________,碳酸钠和二氧化碳是否够用 。
(5)电解Al2O3制Al时,I=200kA,一天制Al 1.430 t,电解效率是多少?






