-
(12分)苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下:
C6H5-CH3+2KMnO4 C6H5-COOK+KOH+2MnO2↓+H2O
C6H5-COOK+KOH+2MnO2↓+H2O
C6H5-COOK+HCl → C6H5-COOH+KCl
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866 g·cm-3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3 g和6.9 g。
【制备产品】30.0 mL甲苯和25.0 mL 1 mol·L-1高锰酸钾溶液在80℃下反应30 min,装置如图所示:
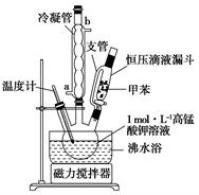
(1)图中支管的作用是_______________________。
(2)在本实验中,三颈烧瓶最合适的容积是________(填字母)
A.50 mL B.100 mL C.200 mL D.250 mL
【分离产品】他们设计如下流程分离粗产品苯甲酸和回收甲苯:
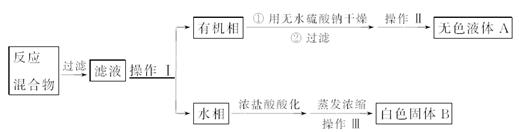
(3)操作Ⅰ的名称是____;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是_______。
(4)操作Ⅲ的名称是____。检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的________溶液,若产生白色沉淀,则B中含有Cl-。
-
苯甲酸是一种消毒防腐剂,其钠盐可抑制牙膏中微生物的生长。甲苯氧化法是实验室制备苯甲酸的常用方法之一。
(一)反应原理
C6H5CH3+2KMnO4 C6H5COOK+KOH+2MnO2↓+H2O
C6H5COOK+KOH+2MnO2↓+H2O
C6H5COOK+HCl→C6H5COOH+KCl
已知:苯甲酸相对分子质量122,熔点122.4℃;苯甲酸在水中的溶解度如下表。
| 温度/℃ | 17.5 | 25 | 75 | 80 | 100 |
| 溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 |
(二)实验过程
①将一定量甲苯、水、几粒沸石加入三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入适量高锰酸钾,搅拌回流反应4小时;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图1)、洗涤、干燥得苯甲酸粗产品。
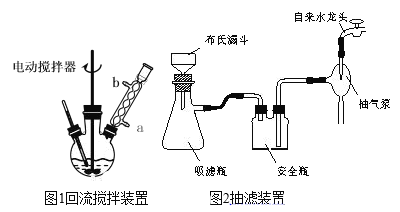
(1)图1电动搅拌器的作用是_____,冷凝管中冷水应从_____(填“a”或“b”)口进入;判断甲苯被氧化完全的实验现象是____。
(2)第③步抽滤操作时,要趁热进行,是因为_____,反应混合物趁热减压过滤后,若溶液呈红色,可用少量NaHSO3溶液处理,反应的离子方程式为_____。
(三)纯度测定
(3)称取1.22g产品溶解在甲醇中配成100mL溶液,移取25.00mL溶液,用KOH标准溶液进行滴定,消耗KOH的物质的量为2.30×10-3mol,产品中苯甲酸质量百分数为____(保留两位有效数字)。
(四)实验反思
(4)得到的粗产品要进一步提纯苯甲酸,可采用_____的方法。
-
苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸(C6H5COOH)和甲醇为原料制备苯甲酸甲酯。有关数据如下:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度(g/cm3) | 水溶性 |
| 苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
| 甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
| 苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。
回答下列问题:
(1)该反应的化学方程式为__________,该反应的原子利用率是_______。
己知:原子利用率=(预期产物的总质量/全部反应物的总质量)×100%
(2)实验中,应选择(如下图)_____(填序号)作为冷凝回流装置,该仪器的名称为______。
(3)使用过量甲醇的原因是__________。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制。
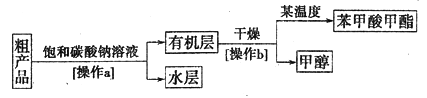
(4)饱和碳酸钠溶液的作用是________,操作a的名称为________。
(5)由于有机层和水层的密度比较接近,兴趣小组的同学无法直接判断有机层在上层还是下层,请你设计简单易行的方案,简述实验方法,可能的现象及结论__________。
(6)该实验中制得苯甲酸甲酯8.30g,则苯甲酸甲酯的产率为________。
-
苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
 +2KMnO4
+2KMnO4
 +KOH+
+KOH+
2MnO2↓+H2O
 +HCl
+HCl
 +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
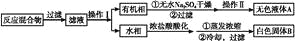
已知:苯甲酸分子量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体, | | 白色晶体
是苯甲酸 |
(4)纯度测定:称取1.220 g产品,配成100 mL甲醇溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3mol。产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。
-
实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
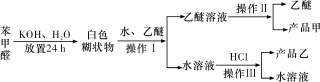
根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
-
实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
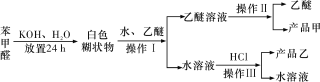
根据以上信息判断,下列说法错误的是
A.操作Ⅰ是萃取分液
B.操作Ⅱ蒸馏得到的产品甲是苯甲醇
C.操作Ⅲ过滤得到的产品乙是苯甲酸钾
D.乙醚溶液中所溶解的主要成分是苯甲醇
-
乙酰苯胺,白色有光泽片状结晶或白色结晶粉未,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。制备原理如下:
C6H5-NH2+ CH3COOH C6H5-NH-CO-CH3+ H2O
C6H5-NH-CO-CH3+ H2O
| 熔点:-6.2℃ | 供点:16.6℃ | 熔点:114.3℃ |
| 沸点:184.4℃ | 沸点:117.9 ℃ | 沸点:304℃ |
| 相对分子量:93 | 相对分子量:60 | 相对分子量:135 |
| 微溶于水 | 密度:1.050g·mL-1 | 微溶于冷水,溶于热水 |
| 易被氧化 | | 呈中性或极弱碱性,遇酸或碱性水溶液易分解成 |
| 密度:1.0217 g·mL-1 | | 苯胺及乙酸 |

实验步骤为:
a.在圆底烧瓶中加入10mL新蒸馏制得的苯胺、15 mL冰醋酸和少许锌粉(约0.2g)和几粒沸石,并连接好装置。
b.用小火加热回流,保持温度在105℃约1小时,当温度下降时表明反应已完成,边搅拌边趁热过滤,然后将反应物倒入盛有250 mL冷水的烧杯中。
c.冷却后抽滤,用冷水洗涤粗产品,将粗产品移至400 mL烧杯中,加入300 mL水并加热使其充分溶解,稍冷,待乙酰苯胺晶体析出,抽滤后压干并称重为12.58 g。
回答下列问题:
(1)A仪器的名称是______________,刺形分馏柱的作用是____________。
(2)加入的锌粉与醋酸反应,化学方程式为____________;其目的是__________________。
(3)从粗产品到晶体,采用的实验方法是____________(填字母)。
A.过滤 B.结晶 C.重结晶 D.抽滤
(4)本实验提高产率的主要措施有____________、____________。
(5)实际产率是____________(保留两位有效数字)。
-
铝镁合金已成为飞机制造.化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的镁铝合金(不含其它元素)中镁的质量分数,设计下列如下实验方案进行探究。填写下列空白:
(方案)将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________________________。
(2)用___________称取5.400 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,为使其反应完全,则NaOH溶液的体积V≥________mL。
(3)__________、洗涤、__________、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将__________(填“偏高”“偏低”或“无影响”)
-
下列说法正确的是 ( )
A.CH3COOH和CH3COOCH3互为同系物
B.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
C.石油分馏可以得到丙烯等重要化工原科
D.C6H14的同分异构体有4种,其熔点各不相同
-
苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下: 2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa C6H5COONa+HCl→C6H5COOH+NaCl
有关物质物理性质如下表:

实验流程如下:


(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。仪器A的名称为__________,若将仪器B改为仪器C,效果不如B,说明原因_____________。
(2)操作中有关分液漏斗的使用不正确的是_______。
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集________℃的馏分。图2中有一处明显错误,正确的应改为______________________________。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用______冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤时应_______________。
(5)用电子天平准确称取0.2440 g苯甲酸样品于锥形瓶中,加100 mL蒸馏水溶解(必要时可以加热),再用0.1000 mol·L-1的标准NaOH溶液滴定,共消耗NaOH溶液19.20 mL,则苯甲酸样品的纯度为__________%。
C6H5-COOK+KOH+2MnO2↓+H2O





 +2KMnO4
+2KMnO4 +KOH+
+KOH+ +HCl
+HCl +KCl
+KCl





