-
硫—碘循环分解水制氢主要涉及下列反应:
① SO2+2H2O+I2===H2SO4+2HI ② 2HI H2+I2 ③ 2H2SO4 === 2SO2+O2+2H2O
H2+I2 ③ 2H2SO4 === 2SO2+O2+2H2O
(1)整个过程中SO2、I2的作用是______。
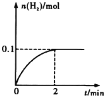
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应②,已知H2的物质的量随时间的变化如图所示,则在0~2 min内的平均反应速率v (HI) =______;
(3)已知拆开1 mol H—I键需要消耗298kJ能量,形成1mol H—H键能够释放436kJ能量,形成1mol I—I键能够释放151kJ能量,则在反应②中,分解0.2mol HI时会______(填“吸收”或“释放”)______kJ能量。
(4)实验室用Zn和硫酸制H2,为了加快反应速率下列措施不可行的是__(填序号)
a.加入浓硝酸 b.加入少量CuSO4 固体 c.用粗锌代替纯锌 d.加热 e.把锌粒弄成锌粉 f.用98.3%的浓硫酸
(5)氢气可用于制燃料电池,某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-== 2H2O ,B极:O2+4e-== 2O2-,则A极是电池的___极;电子从该极___(填“流入”或“流出”)。
-
已知如下反应:2HI+H2SO4(浓)=I2+SO2↑ +2H2O;I2+SO2+2H2O=2HI+H2SO4(稀)。有关上述反应的结论正确的是( )
A. 上述两个反应是矛盾的 B. 氧化性:浓H2SO4>I2>稀H2SO4
C. 氧化性:l2>浓HSO4>稀H2SO4 D. 无法比较浓H2SO4、I2、稀H2SO4的氧化性
-
根据下列反应
①2H2S+SO2= 3S↓+2H2O ②2FeCl2+Cl2= 2FeCl3
③2FeCl3+2HI= 2FeCl2+2HCl+I2 ④I2+SO2+H2O= H2SO4+2HI
判断氧化性物质的氧化性由强到弱的顺序是
A. Cl2>I2>FeCl3>SO2>S B. Cl2>FeCl3>SO2>I2>S
C. Cl2>FeCl3>I2>SO2>S D. FeCl3>Cl2>I2>SO2>S
-
根据下列三个反应的化学方程式,判断有关物质的还原性的强弱顺序:
①I2+SO2+2H2O==H2SO4+2HI;
②2FeCl2+Cl2==2FeCl3;
③2FeCl3+2HI==2FeCl2+I2+2HCl
A.I->Fe2+>Cl->SO2
B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2
D.SO2>I->Fe2+>Cl-
-
根据下列三个反应的化学化学方程式,判断下列关系式不正确的是
(1)I2+SO2+2H2O===H2SO4+2HI
(2)2FeCl3+2HI===2FeCl2+2HCl+I2
(3)2FeCl2+Cl2===2FeCl3
A.氧化性:Cl2>Fe3+>I2>H2SO4
B.还原性:SO2>I->Fe2+>Cl-
C.2Fe+3I2===2FeI3
D.FeI2+Cl2===FeCl2+I2(Cl2不足时)
-
根据下列三个反应的化学化学方程式,判断下列关系式不正确的是
(1)I2+SO2+2H2O===H2SO4+2HI (2)2FeCl3+2HI===2FeCl2+2HCl+I2
(3)2FeCl2+Cl2===2FeCl3
A.氧化性:Cl2>Fe3+>I2>H2SO4 B.还原性:SO2>I->Fe2+>Cl-
C.2Fe+3I2===2FeI3 D.FeI2+Cl2===FeCl2+I2(Cl2不足时)
-
根据以下4个反应:
①H2S+I2=S↓+2I-+2H+, ②SO2+2H2S=3S+2H2O,
③2I-+Br2=I2+2Br-, ④SO2+I2+2H2O=H2SO4+2HI。
确定Br-、I-、H2S、SO2的还原性由强到弱的顺序是
A. H2S>SO2>I->Br- B. I->Br->SO2>H2S
C. H2S>I->Br-> SO2 D. I->Br->H2S>SO2
-
根据下列反应的化学方程式:①I2+SO2+2H2O=H2SO4 +2HI;②2FeCl2+Cl2=2FeCl3;③2FeCl3+2HI=2FeCl2+2HCl+I2 判断有关物质的还原性强弱顺序是( )
A. I->Fe2+>Cl->SO2
B. Cl->Fe2+>SO2>I-
C. Fe2+>I->Cl->SO2
D. SO2>I->Fe2+>Cl-
-
已知下列几个反应的化学方程式:
①2KI+Cl2=2KCl+I2;
②2FeCl2+Cl2=2FeCl3;
③2FeCl3+2HI=2FeCl2+I2+2HCl;
④I2+SO2+2H2O=H2SO4+2HI。下列有关物质的氧化性的强弱排列顺序中正确的是
A.Cl2>Fe3+>I2>SO2 B.Cl2>I2>Fe3+>SO2
C.Cl2>Fe3+>SO2>I2 D.Fe3+>I2>Cl2>SO2
-
根据下列反应的化学方程式:①I2+SO2+2H2O=H2SO4 +2HI;②2FeCl2+Cl2=2FeCl3;③2FeCl3+2HI=2FeCl2+2HCl+I2 判断有关物质的还原性强弱顺序是
A. I->Fe2+>Cl->SO2 B. Cl->Fe2+>SO2>I-
C. Fe2+>I->Cl->SO2 D. SO2>I->Fe2+>Cl-
H2+I2 ③ 2H2SO4 === 2SO2+O2+2H2O
