-
已知一定温度下:①N2(g)+O2(g)===2NO(g) ΔH1=+180 kJ·mol-1 ②N2(g)+3H2(g) 2NH3(g) ΔH2=-92.4 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1下列说法正确的是( )
2NH3(g) ΔH2=-92.4 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1下列说法正确的是( )
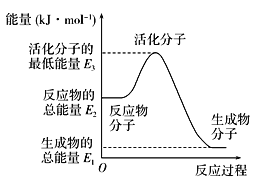
A. 反应②中的能量变化如上图所示,则ΔH=E1-E3
B. 2 mol H2(g)完全燃烧生成液态水时放出的热量小于483.6 kJ
C. 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
D. 氨催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
-
H2或CO可以催化还原NO以达到消除污染的目的。已知一定温度下
①N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
下列有关说法错误的是( )
A.H2催化还原NO生成氮气和液态水的热化学方程式为:2H2(g)+2NO(g)=N2(g)+2H2O(l) ΔH=-752.1kJ·mol-1
B.汽车排气筒内安装尾气催化转化器可大大降低氮氧化物的排放
C.硝酸厂产生的尾气只要通入一定量氢气即可达到排放标准
D.CO催化还原NO生成无污染的气体33.6L(标准状况),放出热量为373.25kJ
-
(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式______________。
(2)某温度下,等物质的量的碘和环戊烯( )在刚性容器内发生反应:
)在刚性容器内发生反应: (g)+ I2(g)
(g)+ I2(g)
 (g)+2HI(g) ΔH=+89.3 kJ·mol −1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
(g)+2HI(g) ΔH=+89.3 kJ·mol −1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中 =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为___________。
-
已知反应: N2(g) +O2(g) 2NO(g),△H=+180.50 kJ·mol-1;△S =247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
2NO(g),△H=+180.50 kJ·mol-1;△S =247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
A. 能使该反应物中活化分子数和活化分子百分数同时增大的方法只能是使用催化剂
B. 到达平衡状态时,v (N2)=2v (NO)
C. 在1000℃时,此反应能自发进行
D. 一定温度下,该反应达到平衡状态后,增加N2的浓度, 化学反应平衡常数变大
-
已知反应: N2(g) +O2(g) 2NO(g),△H=+180.50 kJ·mol-1;△S =247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
2NO(g),△H=+180.50 kJ·mol-1;△S =247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
A. 能使该反应物中活化分子数和活化分子百分数同时增大的方法只能是使用催化剂
B. 到达平衡状态时,v (N2)=2v (NO)
C. 在1000℃时,此反应能自发进行
D. 一定温度下,该反应达到平衡状态后,增加N2的浓度, 化学反应平衡常数变大
-
已知反应: N2(g) +O2(g) 2NO(g),△H=+180.50 kJ·mol-1;△S =247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
2NO(g),△H=+180.50 kJ·mol-1;△S =247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
A. 能使该反应物中活化分子数和活化分子百分数同时增大的方法只能是使用催化剂
B. 到达平衡状态时,v (N2)=2v (NO)
C. 在1000℃时,此反应能自发进行
D. 一定温度下,该反应达到平衡状态后,增加N2的浓度, 化学反应平衡常数变大
-
(15分)含氮化合物对人类生活有十分重大的意义。
(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合。
已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+ O2(g)=2H2O(g) △H=-483.6kJ/mol
①写出工业合成氨的热化学方程式: 。
②实验室模拟合成氨,在2L密闭容器中投入1molN2 和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为 ;达平衡时,N2的转化率为 。

③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,再达平衡时,N2的体积分数将 ,平衡常数 (填“增大”“减小”或“不变”)
(2)科学家一直致力于研究常温常压下“人工固氮”的方法。据报道:在常温常压条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水反应,生成NH3和一种单质。进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
| T/℃ | 30 | 40 | 50 |
| NH3生成量/10-6mol | 4.8 | 5.9 | 6.0 |
①写出常温下“人工固氮”反应的化学方程式: _此反应△H 0(填“>”、“<”或“=)。
②该反应中的催化剂TiO2的制取方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。写出TiCl4水解的化学方程式: 。
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是 。
A.适当升高温度 B.将氨气液化分离
C.增大反应物N2的浓度 D.增大压强
-
为消除NO对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
已知:①N2 (g)+O2 (g) 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
②4NH3 (g)+5O2 (g) 4NO(g) +6H2O(g) △H=-905.48 kJ·mol-1
4NO(g) +6H2O(g) △H=-905.48 kJ·mol-1
则反应4NH3 (g)+6NO(g) 5N2 (g)+6H2O(g)的△H是( )
5N2 (g)+6H2O(g)的△H是( )
A.+2.98 kJ·mol-1 B.-2.98 kJ·mol-1
C.+1807.98 kJ·mol-1 D.-1807.98 kJ·mol-1
-
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol,N2(g)+O2(g)===2NO(g) ΔH=+180 kJ/mol,则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH是( )
A.-386 kJ/mol B.+386 kJ/mol C.-746 kJ/mol D.+746 kJ/mol
-
已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1
N2(g)+O2(g)═2NO(g)△H=+180kJ•mol﹣1
则2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H是( )
A.﹣386 kJ•mol﹣1 B.+386 kJ•mol﹣1 C.﹣746 kJ•mol﹣1 D. +746 kJ•mol﹣1
2NH3(g) ΔH2=-92.4 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1下列说法正确的是( )

