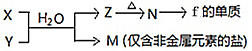-
随原子序数的递增,八种短周期元素(用英文小写字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
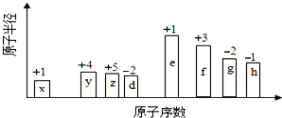
根据判断出的元素回答问题:
(1)f在元素周期表的位置是_________________。
(2)比较d、e简单离子的半径大小(用化学式表示,下同)_____________;比较g、h的最高价氧化物对应的水化物的酸性强弱是______________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式________________。
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:____________________________________________。
(5)由元素f、h形成的物质X与由元素x、z形成的化合物Y可发生以下反应:
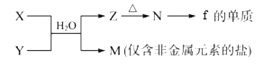
①写出X溶液与Y溶液反应的离子方程式____________________________________;
②写出工业上制备f的单质的化学方程式____________________________________。
-
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
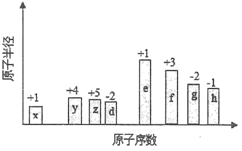
根据判断出的元素回答问题
(1)g的原子结构示意图为______________.
(2)比较e、h 简单离子的半径大小(用化学式表示,下同),_______>_________ .
比较g 、h 的最高价氧化物对应的水化物的酸性强弱是:_________>____________.
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________ .
(4)己知lmole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出表示e 的单质燃烧热的热化学方程式:__________________________.
(5)上述元素可组成常见的碱性气体R。回答下列问题:
①.R极易溶于水的原因是(任意写出两点):
A.__________________________.
B.__________________________.
② 用方程式表示R 的溶液显碱性的原因:______________________.
③ 对pH =" 10" 的R 溶液进行下列操作,能使R 的电离平衡逆移的是____________.
A.加入少量 NaCl溶液 B.加入少量1mol.L-1的NH4Cl溶液
C.加入少量MgSO4固体 D.加入少量1mol.L-1 的NaOH溶液
-
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
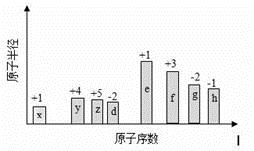
根据判断出的元素回答问题:
(1)d在元素周期表的位置是__________。
(2)d、e、f常见简单离子的半径由大到小为___________(用化学式表示,下同);y、f、g、h的最高价氧化物对应的水化物的酸性由强到弱是:______________________________。
(3)用电子式表示由x和g两种元素形成的化合物的形成过程____________________。由x、y、d三种元素形成的相对分子质量最小的化合物可作为燃料电池的燃料,以KOH溶液为电解质溶液,写出负极反应式为 。
-
随原子序数的递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
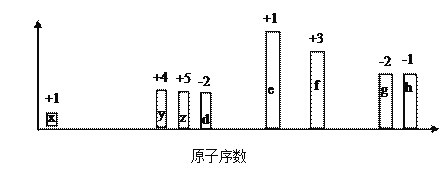
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同)________________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:__________。
(4)已知1mol e 的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:__________________。
-
随原子序数的递增,七种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答:
(1)x在元索周期表的位置是________________________。
(2)y的最高价氧化物对应的水化物与其氢化物反应,产物中含有化学键的类型为________________。
(3)d的单质在空气中充分燃烧,所得产物的电子式为________;7.8 g该产物与足量的水完全反应,转移电子的数目为____________________。
(4)z、e、f的简单离子半径由大到小的顺序为_______________(用离子符号表示)。
(5)能说明g的非金属性比f强的实验事实是________________(列举一条)。
-
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题:
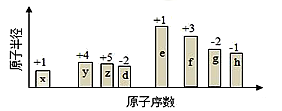
(1)f 在元素周期表的位置是__________。
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:_______>________>_______。(用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为__________;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为____________。(填序号)
 A.MnO2 B.FeCl3 C.Na2SO3 D.KMnO4
A.MnO2 B.FeCl3 C.Na2SO3 D.KMnO4
 (4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
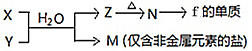
①
 X溶液与Y溶液反应的离子方程式为__________________________
X溶液与Y溶液反应的离子方程式为__________________________
②常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至________________
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1mol·L-1 R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示:
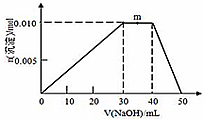
①写出m点反应的离子方程式____________。
②若R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____________mol。
-
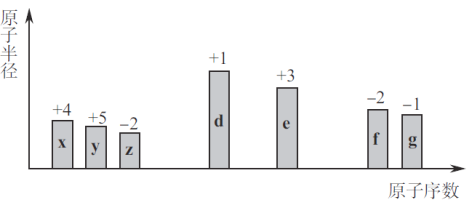
随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
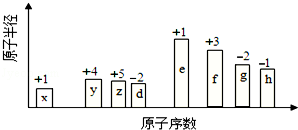
根据判断出的元素回答问题:
(1)f 在元素周期表的位置是 ;g的离子结构示意图为 .
(2)在z、d、e、f 四种元素中,其离子半径按由大到小的排列顺序为 (用化学式表示,下同);比较g、h的最高价氧化物对应的水化物的酸性较强的是: .
(3)由x和z元素组成一种四原子共价化合物,写出其电子式 .
(4)由x、z、h三种元素构成的盐,其水溶液显酸性,用离子方程式解释其原因 .
(5)已知1mol e 的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
-
随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h
的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
-
随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
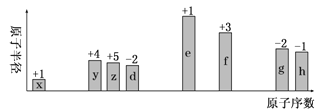
根据判断出的元素回答问题:
(1)z在周期表中的位置是_________________________________。
(2)写出x和d组成的一种四原子共价化合物的电子式_______________。
(3)y、g、h的最高价氧化物对应水化物的酸性最强的是______________(填化学式)。
(4)写出f的最高价氧化物与e的最高价氧化物对应的水化物反应的离子方程式______。
(5)已知e和g的最高价氧化物对应的水化物的稀溶液反应生成1mol水时所放出的热量为Q kJ。请写出该反应的中和热的热化学方程式___________。
(6)用y元素的单质与f元素的单质可以制成电极浸入由x、d、e三种元素组成的化合物的溶液中构成电池负极反应式为___________________________________。
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的最高正价与最低负价的代数和为6,下列判断正确的是

A.原子半径:rW>rZ>rY>rX
B.Y的氧化物是酸性氧化物,不与任何酸反应
C.最简单气态氢化物的热稳定性:H2W>ZH4
D.X元素的非金属性比Y元素的强