-
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s)+H2O(g)  CO(g)+H2(g)。
CO(g)+H2(g)。
而C(g)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
③CO(g)+ O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
请你根据上述信息回答下列问题:
(1)煤是一种成分复杂的混合物,其中除含碳、氢元素外,还含有氧、硫、氮、砷、硒等元素。所以固体煤燃烧会导致大气污染,写出煤燃烧产生的两种污染: ,将石灰石粉与煤粉混合,可以有效地减少煤燃烧过程中的二氧化硫污染,写出该反应的化学方程式:____________________
(2)根据已知热化学方程式写出由煤制备水煤气的热化学方程式:____________________________。
(3)下面是甲、乙两位同学对上述热化学方程式及煤燃烧的理解。
甲同学:1 mol CO与1 mol H2燃烧放出的热量之和大于1 mol固体炭燃烧放出的热量,所以煤燃烧时加入少量水,可以使煤燃烧放出更多的热量。
乙同学:根据下面的物质与能量循环,将煤炭转化为水煤气,再燃烧放出的热量与直接燃烧煤炭放出的热量相同,而将煤炭转化为水煤气将会增加消耗,故煤炭转化为水煤气得不偿失。
C(s)+H2O(g)+O2(g)  CO2(g)+H2O(g)
CO2(g)+H2O(g)


CO(g)+O2(g)+H2(g)  CO(g)+H2O(g)+
CO(g)+H2O(g)+ O2(g)
O2(g)
请你评价两位同学的理【解析】
①甲同学的说法 (答“正确”或“不正确”),原因是______________________________________。
②乙同学的说法 (答“正确”或“不正确”),原因是_____________________________________。
-
将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g)。C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g)。C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484.0 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:__________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
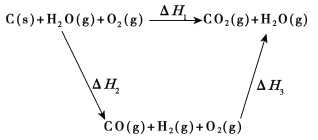
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。请甲、乙两同学观点正确的是_____(填“甲”或“乙”);判断的理由是_________________________________________。
(3)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:
①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
-
将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:______________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
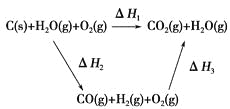
请甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点___________________________________________________。
-
将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)═CO2(g);△H=﹣393.5kJ•mol﹣1
H2(g)+ O2(g)═H2O(g);△H=﹣242.0kJ•mol﹣1
O2(g)═H2O(g);△H=﹣242.0kJ•mol﹣1
CO(g)+ O2(g)═CO2(g);△H=﹣283.0kJ•mol﹣1
O2(g)═CO2(g);△H=﹣283.0kJ•mol﹣1
请回答:(1)根据以上数据写出C(s)与水蒸气反应的热化学反应方程式: .
(2)比较反应热数据可知,1mol CO(g)和1mol H2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出右面循环图:并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”.请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”);判断的理由是 .

-
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C+H2O CO+H2。 C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO+H2。 C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1①
H2(g)+  O2(g)=H2O(g) △H2=-242.0kJ·mol-1②
O2(g)=H2O(g) △H2=-242.0kJ·mol-1②
CO(g)+  O2(g)=CO2(g) △H3=-283.0kJ·mol-1③
O2(g)=CO2(g) △H3=-283.0kJ·mol-1③
(1)请你根据以上反应,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:__________________。
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量________(填“多”或“少”)。
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量。”乙同学根据盖斯定律作出了下列循环图:

请你写出△H1、△H2、△H3、△H4之间存在的关系式:________________________________。
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”)同学,另一同学出现错误观点的原因是_________。
-
(3分)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1 。 已知:
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1 = ________。
-
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO(g)和H2(g)的热化学方程式: 。

(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键键能:P—P 198 kJ·mol-1,Cl—Cl 243 kJ·mol-1,P—Cl 331 kJ·mol-1。则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热ΔH= 。
-
化学能的转化在现实生活中得到了广泛的利用。回答以下问题:
(Ⅰ)(1) 在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧的热化学方程式:
________。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 = —702 kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 = —182 kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3=________。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
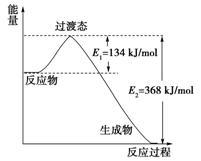
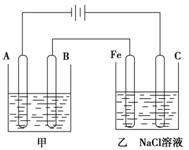
(Ⅱ)下图为相互串联的甲乙两个电解池:
请回答:
(1)甲池若为用电解原理精炼铜的装置,则:
A极是 极,材料是________,电极反应为 ,
B极是 极,材料是________,电极反应为 ,
电解质溶液为 。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色。
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积
________________________________。
(4)同时若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
__ _____。
-
煤的直接燃烧会对大气造成严重污染,是雾霾形成的一个重要原因。实现煤的清洁利用迫在眉睫。乙醇、甲醇、尿素等均与煤化工相关。
Ⅰ.(1)将煤转化成水煤气可有效提高能源利用率:
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
(2)一定温度下,在体积可变的容器中投入反应物进行此反应,则下列说法正确的是
A.体系中加入催化剂(其他条件保持不变),平衡不移动但反应的ΔH 将变大
B.若正、逆反应比值恒定,则说明平衡已建立
C.建立平衡后,加压,气体的平均相对分子质量将增大
D.建立平衡后,加压,平衡向逆方向移动,平衡常数减小
Ⅱ.乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
在一定压强下,测得上述反应的实验数据如下表。
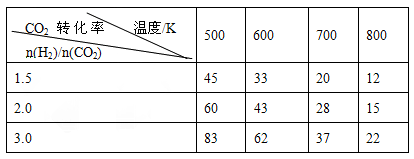
根据表中数据分析:
(3)上述反应的a 0(填“>”“<”或“=”)
(4)在温度为T1时,该反应的平衡常数K=1,在2L密闭容器中加入一定量体系各物质,反应的某时刻测得反应体系中各气体均为1mol。
①此时V(CO2)正= V(CO2)逆(填“>”“<”或“=”)
②若反应在恒压绝热容器中进行,达平衡后,CO2的物质的量
A.大于1mol B.等于1mol C.小于1mol D.不确定
Ⅲ.CO2亦是合成尿素的重要原料,以CO2与NH3为原料合成尿素[化学式为[CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) ΔH=+l59.5kJ·mol-1
②NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
-
化学与生活息息相关,下列说法正确的是( )
A.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
B.食用白糖的主要成分是蔗糖
C.煤气的主要成分是丁烷
D.植物油的主要成分是高级脂肪酸
CO(g)+H2(g)。C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:







