-
钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿 (主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:
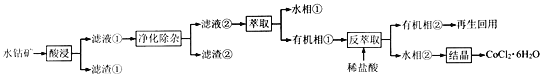
回答下列问题:
Ⅰ.“酸浸”
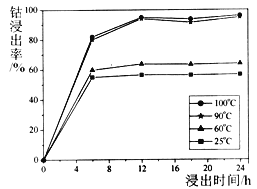
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为______、______;滤渣①的主要成分为_______。
(2) Co2O3与浓硫酸反应生成CoSO4的化学方程式为_________。
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12离子方程式为____________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=_____mol·L-1 (取两位有效数字)。已知:Ksp(MgF2)=7.4×10-11, Ksp(CaF2)=1.5×10-10。
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=______(产率= )。
)。
-
钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
Ⅰ.“酸浸”
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为_________、_________;滤渣①的主要成分为__________。

(2)Co2O3与浓硫酸反应生成CoSO4,化学方程式为______________________________。
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,离子方程式为____________________________________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=_____________mol·L-1 (取两位有效数字)。已知:Ksp(MgF2)=7.4×10-11,Ksp(CaF2)=1.5×10-10。
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________。
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=______(产率= )。
)。
-
钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
(1)“酸浸”
①钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为_________________;滤渣A的主要成分为__________。

②写出Co2O3与浓硫酸反应生成CoSO4的化学方程式___________________________。
(2)“净化除杂”过程包括除铁、除钙镁、除铜等步骤。
①除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,写出反应的离子方程式____________________________________。
②除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,Na2S2O3中硫元素的化合价是___________,上述反应每消耗15.8 g Na2S2O3,反应中转移电子___________mol。
(3)“萃取和反萃取”
①“水相C”中的溶质主要是Na2SO4和________(写化学式)。
②实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=____________(产率= )。
)。
-
钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:
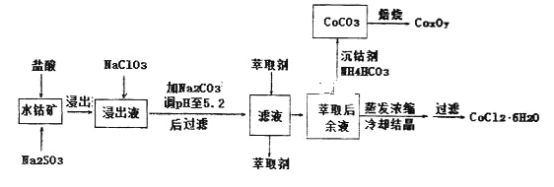
已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________。
(2)写出NaC1O3发生反应的主要离子方程式:______________________________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________。
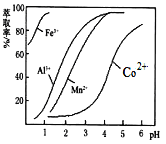
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________;萃取剂使用的最佳pH范围是__________(填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5
(5)“沉钴”时生成CoCO3的离子方程式为__________________________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。
-
氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH) 、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡。
Ⅱ.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a [主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b。
Ⅳ.Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400 ℃~600 ℃煅烧,即得到Co2O3。
请回答:
(1)Ⅰ中,稀硫酸溶解CoCO3的化学方程式是________,加入Na2SO3溶液的主要作用是________。
(2)根据图1、图2分析:
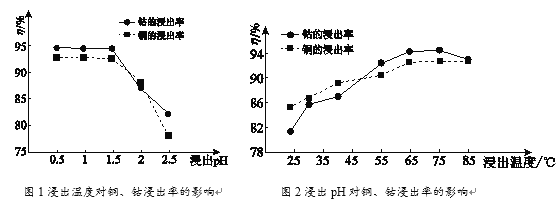
①矿石粉末浸泡的适宜条件应是________。
②图2中铜、钴浸出率下降的可能原因是________。
(3)Ⅱ中,浸出液中的金属离子与NaClO3反应的离子方程式:ClO3− + + == Cl− + + __________ ,________________
(4)Ⅱ中,检验铁元素完全除去的试剂是________,实验现象是________。
(5)Ⅱ、Ⅳ中,加入Na2CO3 的作用分别是________、________。
(6)Ⅲ中,沉淀b的成分是MgF2 、________(填化学式)。
(7)Ⅴ中,分离出纯净的CoC2O4·2H2O的操作是________。
-
氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
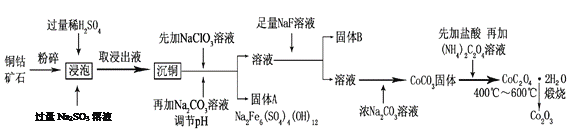
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
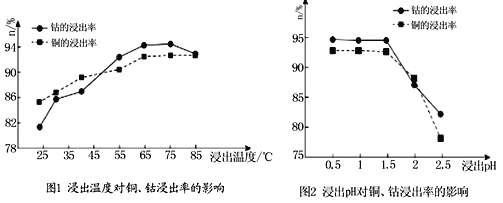
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2  C6 +LiCoO2
C6 +LiCoO2
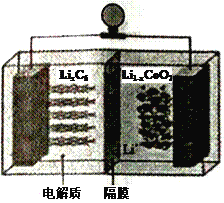
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
-
氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
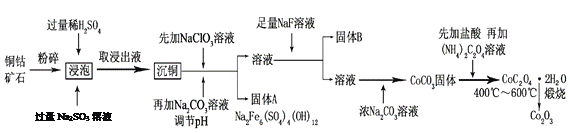
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
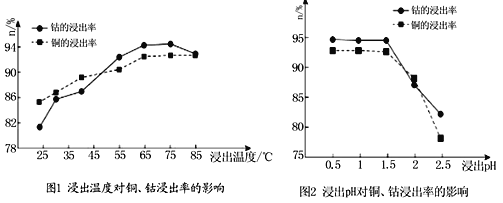
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2  C6 +LiCoO2
C6 +LiCoO2
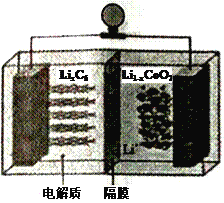
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
-
钴的氧化物广泛应用于磁性材料及超导材料等领域。一种利用含钴废料(主要成分Co2O3,含少量Al2O3、MgO、SiO2 等)制备Co2O3的工艺流程如下图所示。
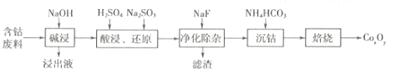
(1)“浸出液”的主要成分是________(写化学式)。
(2)“酸浸,还原”过程中溶解Co2O3的离子方程式为______________。稀硫酸和Na2SO3也可用盐酸替代,工业生产中不用盐酸的理由是_____________。
(3)NaF的作用是____________。
(4)“沉钴”时生成CoCO3的化学方程式为___________。检验CoCO3是否洗涤干净的操作方法是_______________。
(5)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344 L(标准状况),则CoxOy的化学式为_____________。
-
某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如下:
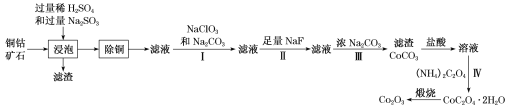
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的化学方程式:________。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=________。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3反应的离子方程式为_______。
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(CO2+)为0.1mol•L–1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为_____。[当c(Mn+)≤10–6 mol•L–1,即认为该金属离子沉淀完全]
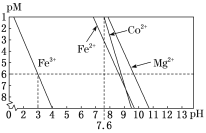
(4)步骤II中加入足量NaF的目的是________。
(5)过滤出的CoC2O4•2H2O固体经洗涤后,证明固体已洗净的操作为________。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为________。
-
某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如图:
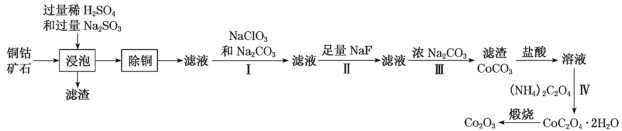
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的相关化学方程式:__。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=__。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3与Fe2+反应的离子方程式为__。
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(Co2+)为0.1mol•L-1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为__。[当c(Mn+)≤10–6mol•L–1,即认为该金属离子沉淀完全]
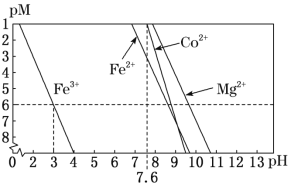
(4)步骤II中加入足量NaF的目的是__。
(5)过滤出的CoC2O4•2H2O固体经洗涤后,证明固体已洗净的操作为__。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为__。


)。

















