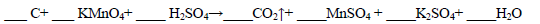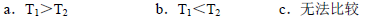-
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯, 请完成该反应的化学方程式
_____C+____ KMnO4+____H2SO4→____CO2↑+_____MnSO4+ ______K2SO4+_____H2O
(2)焦炭可用于制取水煤气,测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量。
反应的热化学方程式为_________________。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)  CH3OH(g) △H=akJ/mol 如表所列数据是反应在不同温度下的化学平衡常数(K)。
CH3OH(g) △H=akJ/mol 如表所列数据是反应在不同温度下的化学平衡常数(K)。

① 判断反应达到平衡状态的依据是___________。(填序号)
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2molCO和一定量的H2充入2L的密闭容器中,充分反应l0min后,达到平衡时测得c(CO)=0.2 mol/L,则以H2表示的反应速率v(H2)=________。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在650℃下的燃料电池,其正极反应式:O2+2CO2+4e-=2CO32-,则负极反应式为___________________。
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层淸液,如此处理多次,可使BaSO4 全部转化为BaCO3发生反应:BaSO4(s) + CO32-(aq)=BaCO3(s) +SO42-(aq)。己知某温度下该 反应的平衡常数 K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积 Ksp=______。
-
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+__K2Cr2O7+__________ →__CO2↑+ __K2SO4 + __Cr2(SO4)3+__H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是 _______;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为________;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
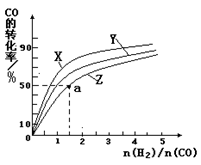
ⅰ)在上述三种温度中,曲线Z对应的温度是________
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)  CH3OH(g)的平衡常数K =________。
CH3OH(g)的平衡常数K =________。
-
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)焦炭可用于制取水煤气。测得12 g碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g) △H=akJ/mol
CH3OH(g) △H=akJ/mol
下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①判断反应达到平衡状态的依据是 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②借助上表数据判断,要同时提高CO的转化率和反应的速率,可采取的措施是 。
A.升温 B.充入H2 C.分离出甲醇 D.加入催化剂
③某温度下,将2 mol CO和一定量的H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c mol/L,则以H2表示的反应速率v(H2)= 。
mol/L,则以H2表示的反应速率v(H2)= 。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和Na2CO3 的熔融盐混合物作电解质, CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在650 ℃下工作的燃料电池,其正极反应式: O2 + 2CO2+4e-=2CO32- ,则 负极反应式:___ ____。
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)  BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp= 。
BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp= 。
-
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
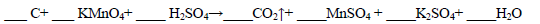
(2)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。
(3)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:

上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= 。
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
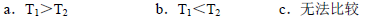
(4)CO2经常用氢氧化钠来吸收,现有0.4 molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在 650 ℃下工作的燃料电池,其负极反应式: 则
则
正极反应式:___ ,电池总反应式 。
-
(12分)欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①请结合上表数据,写出NO与活性炭反应的化学方程式________。
②根据上述信息判断,温度T1和T2的关系是(填序号)________。
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:________
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质, CO 为阳极燃气,空气与 CO2 的混和气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO + 2CO32- =4CO2 +4e- 则 阴极反应式: ,电池总反应式:________。
-
欧盟定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6
kJ热量。该反应的热化学方程式: 。
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|  物质 物质
T/℃ n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数为 K1,T2℃时的平衡常数为 K2。
Ⅰ.K1 = 。(列式并计算)
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有很高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO 为阳极燃气,空气与 CO2 的混合气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO-4e—+ 2CO32— =4CO2 ,则阴极反应式为: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
-
欧盟征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢碳纳米管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,请完成并配平下述化学方程式:
口C+口K2Cr2O7+口______=口CO2↑+口K2SO4+口Cr2(SO4)3+口H2O
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=-116kJ/mol
①下列措施中有利于增大该反应的反应速率的是_______(填字母代号)。
A.随时将CH30H与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ/mol
则表示lmol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________。
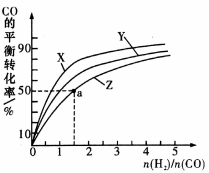
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃ 三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。

请回答:
i)在上述三种温度中,曲线Z对应的温度是_________;
ii)利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g)=CH3OH(g)的平衡常数K=__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______________。
-
欧盟征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢碳纳米管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,请完成并配平下述化学方程式:
口C+口K2Cr2O7+口______=口CO2↑+口K2SO4+口Cr2(SO4)3+口H2O
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=-116kJ/mol
①下列措施中有利于增大该反应的反应速率的是_______(填字母代号)。
A.随时将CH30H与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ/mol
则表示lmol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________。
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃ 三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。
请回答:
i)在上述三种温度中,曲线Z对应的温度是_________;
ii)利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g)=CH3OH(g)的平衡常数K=__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______________。
-
欧盟征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢碳纳米管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,请完成并配平下述化学方程式:
口C+口K2Cr2O7+口______=口CO2↑+口K2SO4+口Cr2(SO4)3+口H2O
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=-116kJ/mol
①下列措施中有利于增大该反应的反应速率的是_______(填字母代号)。
A.随时将CH30H与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ/mol
则表示lmol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________。
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃ 三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。

请回答:
i)在上述三种温度中,曲线Z对应的温度是_________;
ii)利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g)=CH3OH(g)的平衡常数K=__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______________。
-
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暧,研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C+___K2Cr2O7+___—___CO2↑+ ___K2SO4+ ___Cr2(SO4)3+___H2O
①完成并配平上述化学方程式。
②在上述方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式________
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为_____________________。
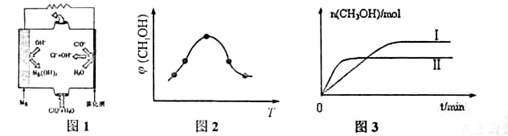
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①该反应的平衡常数表达式为K_______。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数 (CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填 “>”、“<”或“ =” )。
(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填 “>”、“<”或“ =” )。
③在同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线 I、II对应的平衡常数大小关系为KI_______KII (填“>”、“<”或“ = ”)。
CH3OH(g) △H1=-116 kJ·mol-1
△H2=-283 kJ·mol-1
△H3=-242 kJ·mol-1

CH3OH(g)的平衡常数K =________。