-
某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
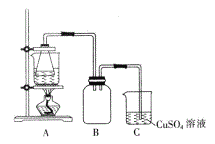
②将处理后的废铁屑放入锥形瓶中,加入适量3mol/L的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________。
(3)装置C的作用是_____________。
(4)步骤④中洗涤时所用的洗涤剂最好是_____________。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后cmol/L的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
滴定过程中发生反应的离子方程式为________;产品的纯度为_________(列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
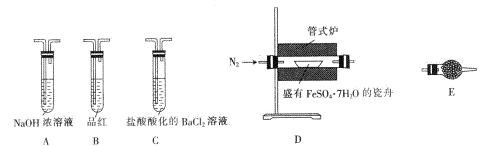
| 操作步骤 | 实验现象 | 解释原因 |
| 组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
| 气体产物经过试管B时 | 品红溶液褪色 | (6)_____________ |
| 气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为_____________ |
| 将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8)_____________ | (9)_____________ |
-
某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
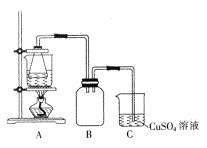
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(3)装置C的作用是__________________________。
(4)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________,KMnO4标准溶液用______(酸或碱)式滴定管,产品的纯度为_______(列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
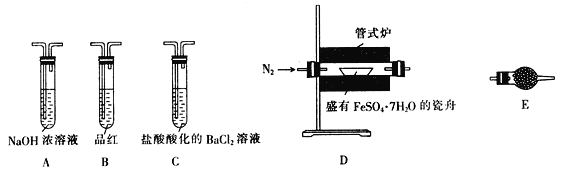
| 操作步骤 | 实验现象 | 解释原因 |
| 组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
| 气体产物经过试管B时 | 品红溶液褪色 | (6) 产物中含有 _________________ |
| 气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为 ___________________________ |
| 将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8)____________________ | (9) 溶液中含有 _______________ |
-
某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
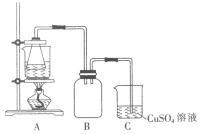
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(2)装置C的作用是__________________________。
(3)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(4)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________;产品的纯度为_________________(列出计算表达式即可)
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
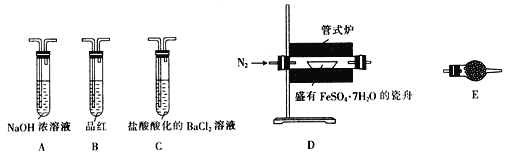
| 操作步骤 | 实验现象 | 解释原因 |
| 组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
| 气体产物经过试管B时 | 品红溶液褪色 | (5)产物中含有___________。 |
| 气体产物经过试管C时 | 试管C中出现白色沉淀 | (6)C中反应的化学方程式为________________________。 |
| 将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (7)_________________。 | (8)溶液中中含有__________。 |
(9)依据实验现象及产物,写出FeSO4·7H2O分解的化学方程式:_________________。
-
实验室可利用硫酸厂炉渣(主要成分为铁的氧化物,还含有少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式为[Fe2( OH)n( SO4)3-0.5n]m,制备过程如图所示。下列说法不正确的是
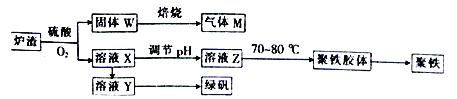
A. 炉渣中FeS与硫酸、氧气反应的离子方程式为4FeS+3O2+12H+=4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C. 若调节溶液Z的pH偏小,则将导致聚铁中铁的质量分数偏大
D. 溶液X转化为溶液Y需要加过量铁粉,再过滤
-
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁[Fe2(OH)n(SO4)3-0.5n] m和绿矾(FeSO4·7H2O),过程如下:

(1)验证固体W焙烧后产生的气体含有SO2的方法是________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→______→_____→______→______→f。_________装置A中发生反应的化学方程式为___________。D装置的作用________。
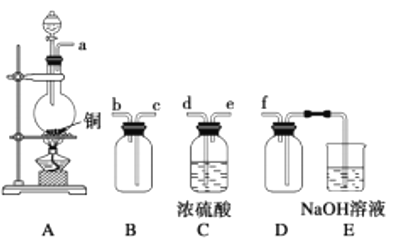
(3)制备绿矾时,向溶液X中加入过量_______,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有______________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
-
硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾(FeSO4·7H2O式量为278),并进一步计算产品的纯度。工艺流程如下所示:
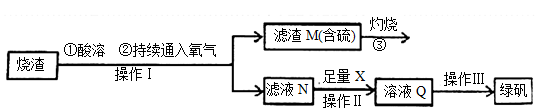
(1)烧渣在进行酸溶时用到的酸为 。
(2)过程灼烧时产生的气体通入下列溶液中,溶液不会褪色的是
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)滤液N中加入X发生反应的离子方程式为 。检验溶液Q中含有的金属阳离子的实验方法是 。
(4)操作III的操作步骤为蒸发浓缩、 、过滤、洗涤、干燥。
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0g产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①计算上述产品中FeSO4·7H2O的质量分数为 ;
②若在a步操作中,进行定容时仰视刻度线定容,则会使测得的产品中FeSO4·7H2O[的质量分数 。(填“偏大”“偏小”或“无影响”)。
-
硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾(FeSO4·7H2O式量为278),并进一步计算产品的纯度。
工艺流程如下所示:
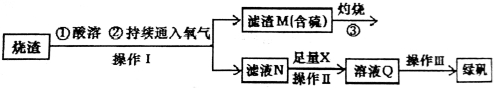
(1)烧渣在进行酸溶时用到的酸为 。
(2)过程灼烧时产生的气体通入下列溶液中,溶液不会褪色的是
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)X是 ,此时滤液N中发生反应的离子方程式为 。检验溶液Q中含有的金属阳离子的实验方法是  。
。
(4)操作III的操作步骤为蒸发浓缩、 、过滤(填操作名称)、 、干燥。
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0g产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①标准液应盛装在 滴定管中(填“酸式”或“碱式”)
计算上述产品中 FeSO4·7H2O的质量分数为 ;
FeSO4·7H2O的质量分数为 ;
②若在a步操作中,进行定容时仰视刻度线定容,则会使测得的产品中FeSO4·7H2O的质量分数 。(填“偏大”“偏小”或“无影响”)。
-
硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾(FeSO4·7H2O式量为278),并进一步计算产品的纯度。
工艺流程如下所示:
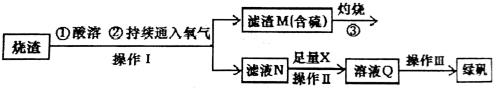
(1)烧渣在进行酸溶时用到的酸为 。
(2)过程中灼烧时产生的气体通入下列溶液中,溶液不会褪色的是
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)X是 ,此时滤液N中发生反应的离子方程式为 。检验溶液Q中含有的金属阳离子的实验方法是 。
(4)操作III的操作步骤为蒸发浓缩、 、过滤(填操作名称)、 、干燥。
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0g产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①标准液应盛装在 滴定管中(填“酸式”或“碱式”),计算上述产品中FeSO4·7H2O的质量分数为 ;
②若在a步操作中,进行定容时仰视刻度线定容,则会使测得的产品中FeSO4·7H2O的质量分数 。(填“偏大”“偏小”或“无影响”)。
-
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
FeSO4•7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
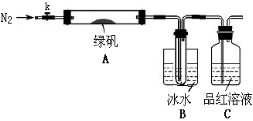 已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
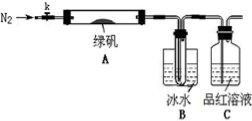
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是 ;
结论2:C中溶液褪色,可推知产物中有 ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足: 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是 。
a.氯水和KSCN溶液 b.酸性KMnO4溶液 c.H2O2 d.NaOH溶液
-
(16分)实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)〔Fe(OH)(SO4)〕n和绿矾(FeSO4·7H2O),过程如下:

(1)在①中已知FeS中铁元素生成Fe3+,S元素生成单质硫,写出FeS、O2、H2SO4反应的离子方程式______________________________________;
(2)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是___________(填编号);
A.品红溶液 B.酸性KMnO4溶液
C.紫色石蕊溶液 D.溴水
(3)在③中,需加入的物质是___________________________;
(4)在④中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有___________________________;
(5)在⑥中,将溶液Z控制到70~80℃的目的是____________________________________;
(6)为测量聚铁样品中铁元素的质量分数,进行下列实验(假设杂质中不含铁元素和硫元素):称取一定质量样品,将样品溶于足量的_________后(填化学式,下同),滴加过量的__________,产生不溶于酸的沉淀,过滤、洗涤、干燥,称量固体的质量来计算该聚铁样品中铁元素的质量分数。
(7)若用步骤③④制取绿矾,测定3g烧渣中氧化铁的质量分数
①取所得绿矾产品,溶解,配制成1000mL溶液;量取25.00mL待测溶液于锥形瓶中,配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需 。
②用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为15.00mL。判断此滴定实验达到终点的方法是 ;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
③计算烧渣中铁元素的质量分数为 。












 已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
