-
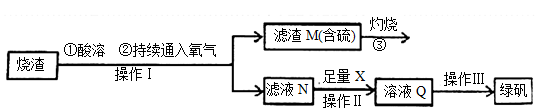
硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。某校化学兴趣小组,利用工业烧渣为原料,设计如下制备硫酸亚铁的方案。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2 等)制备绿矾(FeSO4·7H2O)。工艺流程如下所示:
(1)烧渣在进行酸溶时用到了稀硫酸。他们在配制所需的稀硫酸时使用了自来水,有同学提出自来水中含有少量的Cl-,会影响到制出的FeSO4 的纯度。请你设计实验证明已配制的稀硫酸中混有Cl-。
_______________________。
(2)过程③灼烧时产生的气体通入下列溶液中, 溶液不会褪色的是___________
溶液不会褪色的是___________
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)X 是 , 此时滤液N 中发生反应的离子方程式为 。检验溶液Q 中含有的金属阳离子的实验方法是 。
(4)操作III 的操作步骤为蒸发浓缩、 、过滤( 填操作名称)、  、干燥。
、干燥。
(5)硫酸亚铁可以用于治疗缺铁性贫血症,某严重贫血患者共需补充2.8g铁元素,服用的药品中相当于需要绿矾的质量为_________。
-
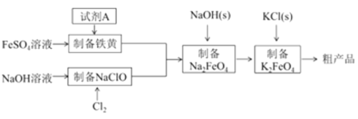
高铁酸钾 (K2FeO4)是一种新型,高效的绿色水处理剂。工业上利用硫酸亚铁为原料,通过铁黄 (FeOOH)制备高铁酸钾,可降低生产成本产品质量优工艺流程如下:
化学兴趣小组的同学们在实验室中,通过KClO溶液与Fe(NO3)3溶液的反应模拟工业生产制备高铁酸钾,下图所示是模拟工业制备KClO溶液装置。
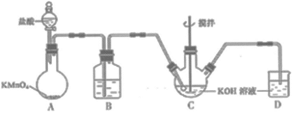
已知:K2FeO4可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解。
(1)工业流程中,需要加入试剂A制备铁黄(FeOOH),最合适的试剂A是:________。
A.Cl2 B.O2 C.KMnO4 D.HNO3
流程中制备铁黄涉及到的离子反应方程式:_______。
实验测得反应溶液的pH对铁黄产率的影响如下图所示,pH大于4.5时铁黄产率逐降低的主要原因可能是:______。
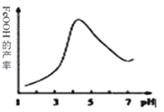
(2)根据工业流程推断,溶解度K2FeO4________ Na2FeO4 (填“>”或“<”)
(3)实验室使用KClO溶液和饱和Fe(NO3)3液制备高铁酸钾时,两种试剂的滴加顺序为________。
(4) K2FeO4在水溶液中易水解,在“提纯”K2FeO4中采用重结晶洗涤、低温烘干的方法,则洗涤剂最好选用____溶液(填序号)
a.水 b.NH4Cl、异丙醇 c. Fe(NO3)3、异丙醇 d.异丙醇
(5)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.00mol/l的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2= Na2S4O6+2NaI),淀粉作指示剂,三次滴定,消耗Na2S2O3标准溶液分别17.98、18.02、18.95mL。原样品中高铁酸钾的质量分数为________。[M(K2FeO4)=198g/mol]
-
铁及其化合物有重要用途,如聚合硫酸铁[]是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H2O(g),写出反应方程式___________________________;
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)_________________;
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
□Fe2O3+□KNO3+□KOH→□ ________ +□KNO2+□ ______
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol・L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 ; I2+2S2O32-═2I-+S4O42-
①滴定选用的指示剂及滴定终点观察到的现象__________________________;
②溶液Ⅰ中铁元素的总含量为__________ g・L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
-
镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
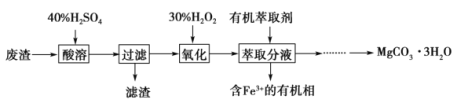
(1)滤渣的成分为_________________(填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理:______________。
(2)加入H2O2一段时间后,溶液中有气泡出现并放热,分析产生气泡的原因:____________(用文字表达)。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并____________________。萃取分液的目的是______________(填字母)。
A.除去水溶液中的铁离子
B.增加镁离子在水中的溶解度
C.富集铁元素,可以回收利用
(4)萃取后得到的水溶液制备MgCO3·3H2O的实验操作:边搅拌边向溶液中滴加Na2CO3溶液至有大量沉淀生成,静置后,进行操作:______________________________,确定沉淀完全后,再过滤、__________________、__________________,得到MgCO3·3H2O。
-
镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
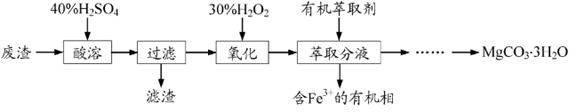
(1)废渣的成分为_________(填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理_____________________。
(2)加入H2O2的目的是__________________,一段时间后,溶液中有气泡出现并放热,则产生气泡的原因是____________。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并________________。萃取分液的目的是____________。(填序号)
A、除去水溶液中的铁离子
B、增加镁离子在水中的溶解性
C、富集铁元素,可以回收利用
(4)萃取后得到的水溶液制备MgCO3·3H2O的实验操作:边搅拌边向溶液中滴加Na2CO3溶液至有大量沉淀生成,静置,________,确定沉淀完全后,过滤、____________,得到MgCO3·3H2O。
-
铁及其化合物有重要用途,如聚合硫酸铁 是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H2O(g),写出反应方程式:_________________________。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-) 。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:

-
某化学兴趣小组以含铁的废铝为原料制备硫酸铝晶体,设计如下的实验方案:

请回答以下问题:
(1)上述实验中多次用到过滤操作,该操作中要用到的玻璃仪器有 ;
(2)步骤②中有洗涤沉淀的操作,如何判断沉淀已洗涤干净: ;
(3)写出步骤②所得沉淀受热分解的化学方程式 ,指出两种产物在物质分类上的类别 、 ;
(4)步骤①中使用的NaOH溶液以4mol/L为宜。某同学称量mgNaOH固体配制V mL 4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中有错误的是(填操作序号) 。
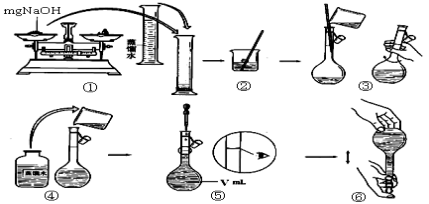
第⑤部操作可能会使所配溶液浓度偏 (填“大”或“小”或“无影响”)
-
某化学兴趣小组利用工业废弃固体(主要成分为Cu2S和FeS2)制备硫酸铜溶液和硫酸亚铁晶体,设计方案如图所示:
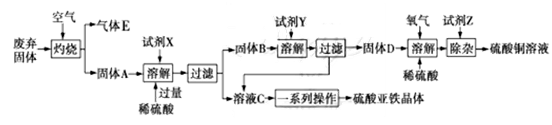
已知:T℃时,Ksp[Cu(OH)2]=2.0×10−20,Ksp[Fe(OH)2]=6.0×10−16,
Ksp[Fe(OH)3]=1.0×10−38。
(1)为了提高废弃固体的灼烧速率,可以采取的措施有____________、___________(写出两条)。
(2)FeS2在空气中灼烧时氧化剂与还原剂的物质的量之比为________。
(3)溶液C在氮气的环境下,通过____________、____________、过滤、洗涤、干燥制取硫酸亚铁晶体。
(4)常温下,固体D、O2和稀硫酸混合后几乎不反应,但加入少量溶液C立即发生反应,则溶液C对该反应起________作用,其中发生反应的离子方程式为_______________________________、__________________________________。
(5)除杂时先加入双氧水,然后加入试剂Z调节溶液的pH值使铁离子完全沉淀:
①加入的试剂Z可以是________。
A. NaOH B.CuO C.Cu(OH)2 D.NH3·H2O
②若除杂时溶液中Cu2+浓度为2.0mol·L−1,则加入试剂Z调节溶液的pH至_______________________。
-
某化学兴趣小组以含铁的废铝为原料制备硫酸铝晶体,设计如下的实验方案:请回答以下问题:

(1)上述实验中多次用到过滤操作,该操作中要用到的玻璃仪器有______;
(2)步骤②中有洗涤沉淀的操作,如何判断沉淀已洗涤干净:______;
(3)评价步骤②的操作中难以控制之处______,请你提出一个合理而比较容易操作的实验方案(药品可任选)______,该反应的分子方程式为:______;
(4)步骤①中使用的NaOH溶液以4mol/L为宜.某同学称量mgNaOH固体配制V m L 4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中错误的是(填操作序号)______.
-
在无机化工中,硫酸亚铁铵[(NH4)2Fe(SO4)2]是制取其它铁系化合物的原料,如制取氧化伯系颜料、磁性材料和黄血盐等。某化学兴趣小组设计如下实验方案,探究(NH4)2Fe(SO4)2完全分解的产物。
已知:①隔绝空气受热完全分解是氧化还原反应。
②98%浓硫酸能顺利吸收SO3。
Ⅰ.甲同学根据以下流程探究分解的部分产物,试回答下列问题:
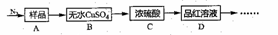
(1)B装置预期的现象是_____;C装置的作用可能是______,D装置可以检验分解产物中是否含有_____。
(2)加热前先通一会儿N2,再关闭气阀,其目的是_______。
Ⅱ.乙同学猜想(NH4)2Fe(SO4)2分解时可能生成了SO3,为了验证他的猜想,小组同学又提供了如右图装置,试回答下列问题:
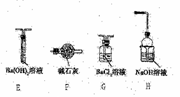
(3)不能选择E和F装置的原因是________。
(4)加热装置A与G、H连接并进行实验,请你提出需要改进的方案________。
(5)已知饱和SO2水溶液中c(SO32-)=6.0×10-8mol•L-1,Ksp(BaSO3)=5.4×10-7。通过计算判断在1.0mol•L-1的BaCl2溶液中,通入足量纯净的SO2能否生成BaSO3沉淀?
(6)当G中出现大量白色沉淀时,并不能说明A中生成了SO3,理由是_______;为了进一步证明是否有SO3生成,请你补充实验方案(不要求写具体的操作过程)_________。