-
用方铅矿精矿( 主要为PbS)和软锰矿(主要为MnO2,还有少量Fe2O3,Al2O3等杂质) 制备PbSO4和Mn3O4的工艺流程如下:
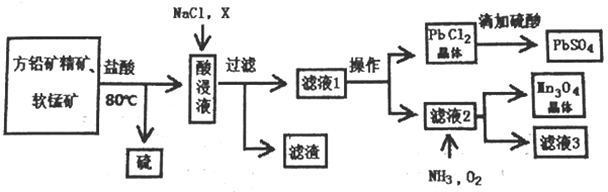
已知:①PbS+MnO2+ 4 H+= Mn2++Pb2++S+2H2O
②25℃ 时,Ksp(PbCl2)=1.6×10-5,Ksp(PbSO4)=1.8×10-8
③PbCl2 (s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_________________;加入物质X可用于调节酸浸液的pH值,物质X可以是___________(填字母)。
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有两种金属杂质形成的化合物,其成分为_____________(写化学式);
请设计分离两种金属化合物的路线图(用化学式表示物质,用箭头表示转化关系,箭头上注明试剂和分离方法)。______________________________________
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式。___________________________________
(5)用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为___________ (填字母)。
A.热还原法 B.电解法 C.热分解法
(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应的平衡常数K=___________(保留到整数位)。
-
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
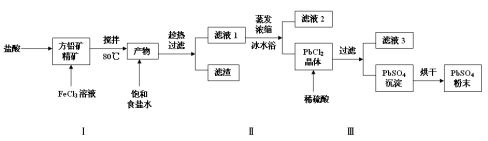
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释加入H2O2后滤液2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
-
软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
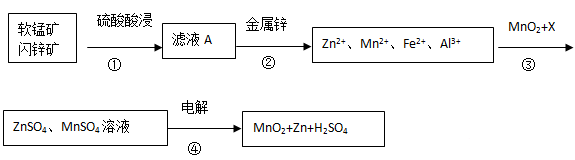
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______。
(2)步骤③中MnO2的其作用是______,另外一种物质X可以是______。
A.MgCO3 B.ZnO C.MnCO3 D.Cu(OH)2
(3)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式______。MnO2可做超级电容器材料,用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是______.
(4)已知:H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
-
软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
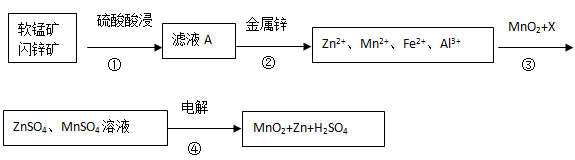
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______。
(2)步骤③中MnO2的其作用是______,另外一种物质X可以是______。
A.MgCO3 B.ZnO C.MnCO3 D.Cu(OH)2
(3)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式______。MnO2可做超级电容器材料,用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是______.
(4)已知:H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
-
软锰矿的主要成分是MnO2,还含有少量(Hg2+等)重金属化合物杂质。黄铁矿的主要成分是FeS2,还含有SiO2和Al2O3等杂质。工业上采用同槽硫酸酸溶等工艺制备碳酸锰并回收硫酸铵,其主要流程如下:( 已知: Ksp[Al(OH) 3]=1 3×10-33,Ksp[Fe(OH) 3]=5.3×10-38,金属离子的浓度小于1×10-6视为沉淀完全。)
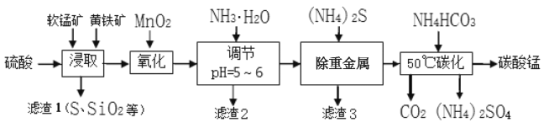
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:
①适当升高温度,②搅拌,③_________________等。
(2)流程“氧化”中加入MnO2与Fe2+发生反应的离子方程式为_________________。
(3)“滤渣2”中主要成分的化学式为_________________。
(4)流程“除重金属”时使用(NH4)2S而不使用Na2S的原因是_________________。
(5)流程“50℃碳化”得到碳酸锰,该反应的化学方程式为_________________。
(6)生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是_________________。
-
以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
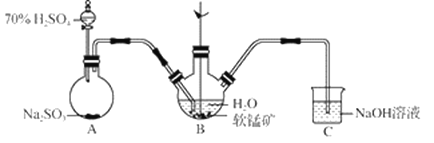
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
| 沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
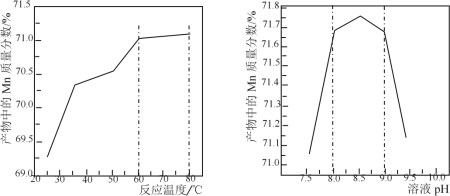
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
-
工业上主要采用软锰矿和闪锌矿联合生产MnO2和锌。软锰矿主要成分为MnO2;还含少量Al2O3和SiO2杂质。闪锌矿主要成分为ZnS,还含少量FeS、CuS杂质。现用稍过量的软锰矿和闪锌矿为原料,经过一系列处理后分别在两个电极生成产品“MnO2和锌”。工艺流程如下:
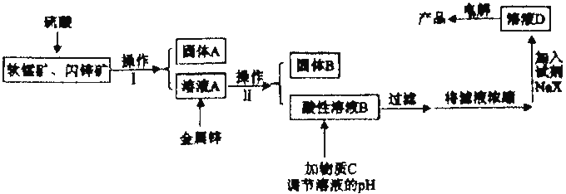
已知:Ⅰ:金属硫化物、硫酸、二氧化锰三者发生的反应均是氧化还原反应。
例如:MnO2+ZnS+2H2SO4 MnSO4+ZnSO4+S+2H2O.
MnSO4+ZnSO4+S+2H2O.
Ⅱ:4X-+Mn2+ MnX42-,X-不参与电极反应。Zn2+与X-不反应。
MnX42-,X-不参与电极反应。Zn2+与X-不反应。
Ⅲ:各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | A13+ |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)操作I的名称是_____________________。
(2)物质C是MnO2和ZnO的混合物。加入物质C充分作用后,过滤,所得固体的成分是________(用化学式表示)。
(3)电解溶液D的装置如下图所示,两个电极都是惰性电极。
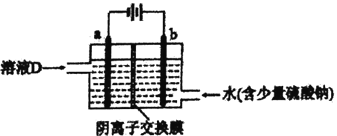
①硫酸钠的作用是________________________。
②b电极的电极反应式是______________________。a电极的电极反应式是_______________________。
(4)若一定质量的闪锌矿中含1.76kgFeS,则在上述流程中1.76kgFeS消耗MnO2的质量为_______kg。
(5)现有0.4mol/L Mn(NO3)2、 0.8mol/LZn(NO3)2的混合溶液100mL,向该混合液中逐滴加入Na2S溶液,当MnS沉淀一定程度时,测得c(Mn2+)=2.0×10-3 mol/L,则此时c(Zn2+)=________[已知Ksp(ZnS)=1.3×10-24,Ksp(MnS)=2.6×10-13]
-
中国的锰矿石和锌矿石产地在云南、广东、青海等。软锰矿是一种常见的锰矿石,其主要成分是MnO2,含少量Al2O3和SiO2。闪锌矿主要成分是ZnS,含少量FeS、CuS、CdS等杂质,晶体属于六方晶系。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下。
已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中MnO2、CuS与硫酸共热时有淡黄色物质析出,请写出该反应的化学方程
式___________________。
(2)步骤②加入适量金属锌是为了回收金属,回收金属的主要成分是_________________。
(3)步骤③中MnO2的作用是________________,另外一种物质X可以是__________。
A.ZnO B.MgO C.Cu2(OH)2CO3 D.MnCO3
(4)锂离子电池的正极材料有多种,其中MnO2与Li构成LiMnO2是一种常见的正极材料。电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式_____________________。
已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,
向NaCN溶液中通入少量的H2S气体,反应的离子方程式为_______________________。
在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1 Mn2+废水
中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×10-15]
-
[化学——选修2:化学与技术]
软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为_______________。
(2)现代冶炼金属锰的一种工艺流程如下图所示:
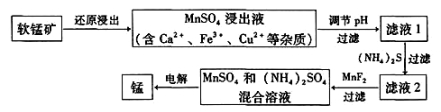
下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4  12MnSO4+6CO2↑+18H2O
12MnSO4+6CO2↑+18H2O
①该反应中,还原剂为_______。写出一种能提高还原浸出速率的措施:_______。
②滤液1的pH_______(填“大于”、“小于”或“等于”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)。
(3)由MnSO4制取MnCO3:往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为____________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq) Mn(OH)2(s)+CO32-(aq),t ℃时,计算该反应的平衡常数K= (填数值)。
Mn(OH)2(s)+CO32-(aq),t ℃时,计算该反应的平衡常数K= (填数值)。
-
软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
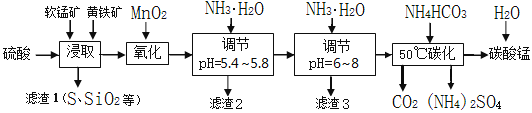
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
| 完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。

PbCl42-(aq) △H>0










