-
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型).Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=______ .Fe(CO)x在一定条件下发生反应:
Fe(CO)x(s) Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为 。
Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为 。
(3)写出CO的一种常见等电子体分子的结构式______;两者相比较沸点较高的为______(填化学式).CN-中碳原子杂化轨道类型为 ,S、N、O三元素的第一电离能最大的为 (用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图所示。
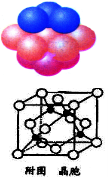
①基态铜原子的核外电子排布式为 。
②每个铜原子周围距离最近的铜原子数目 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
①该晶体的化学式为 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 (填“离子”、“共价”)化合物。
③已知该晶体的密度为 g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。
g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。
-
【化学-选修3:物质结构与性质】(15分)
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是_________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式_______;两者相比较沸点较高的为_____(填化学式)。CN-中碳原子杂化轨道类型为_______,C、N、O三元素的第一电离能最大的为____(用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示。
①基态铜原子的核外电子排布式为___________。
②每个铜原子周围距离最近的铜原子数目________。
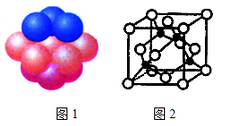
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为___________pm(只写计算式)。
-
铁、铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)铁元素在周期表中的位置是_______,基态Cu2+的核外电子排布式是__________。元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu>IFe的原因是_________________。
(2)有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为:[Fe(H2NCONH2)6](NO3)3。
①尿素分子中C原子的杂化方式是__________。
②[Fe(H2NCONH2)6](NO3)3 中“H2NCONH2”与 Fe(Ⅲ)之间的作用力是_______。根据价层电子对互斥理论推测 NO3-的空间构型为____________。
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_______, 原因是______________。
(4)FeCl3晶体易溶于水和乙醇,用酒精灯加热即可气化,由此可知 FeCl3的晶体类型为______;S和Fe形成的某化合物,其晶胞如图一所示, 则该物质的化学式为__________。
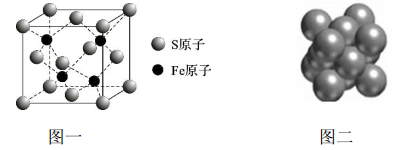
(5)Cu晶体的堆积方式如图二所示,晶体中Cu原子的配位数为_______;设Cu原子半径为a,晶体空间利用率为 _________(用含a 的式子表达,不化简)。
-
铁、铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)铁元素在周期表中的位置是_______,基态Cu2+的核外电子排布式是__________。元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu>IFe的原因是_________________。
(2)有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为:[Fe(H2NCONH2)6](NO3)3。
①尿素分子中C原子的杂化方式是__________。
②[Fe(H2NCONH2)6](NO3)3 中“H2NCONH2”与 Fe(Ⅲ)之间的作用力是_______。根据价层电子对互斥理论推测 NO3-的空间构型为____________。
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_______, 原因是______________。
(4)FeCl3晶体易溶于水和乙醇,用酒精灯加热即可气化,由此可知 FeCl3的晶体类型为______;S和Fe形成的某化合物,其晶胞如图一所示, 则该物质的化学式为__________。

(5)Cu晶体的堆积方式如图二所示,晶体中Cu原子的配位数为_______;设Cu原子半径为a,晶体空间利用率为 _________(用含a 的式子表达,不化简)。
-
【化学-选修3:物质结构与性质】
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是______________,基态铜原子的核外电子排布式为________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____________(填晶体类型)。
(3)CO和CO的一种生活中常见等电子体分子,两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为_______________,C、N、O三元素的第一电离能最大的为_______________(用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示。每个铜原子周围距离最近的铜原子数目__________。
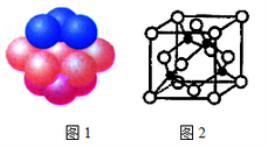
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为_____________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,已知该晶体中铜原子和M原子之间的最短距离为体对角线的1/4,则该晶体中铜原子和M原子之间的最短距离为_______________pm(只写计算式)。
-
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是______,基态铜原子的核外电子排布式为______。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______ 填晶体类型
填晶体类型 。
。
(3)写出CO的一种常见等电子体分子的结构式______,两者相比较沸点较高的为______(填化学式)。CN-中碳原子杂化轨道类型为______,C、N、O三元素的第一电离能最大的为______ 用元素符号表示
用元素符号表示 。
。
(4)铜晶体中铜原子的堆积方式如图所示:

M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
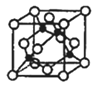
 该晶体的化学式为______。
该晶体的化学式为______。
 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
 已知该晶体的密度为
已知该晶体的密度为 g•cm-3,阿伏伽德罗常数为NA,已知该晶体中铜原子和M原子之间的最短距离为体对角线的
g•cm-3,阿伏伽德罗常数为NA,已知该晶体中铜原子和M原子之间的最短距离为体对角线的 ,则该晶体中铜原子和M原子之间的最短距离为______pm(只写计算式)。
,则该晶体中铜原子和M原子之间的最短距离为______pm(只写计算式)。
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
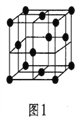
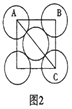
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
-
Al、Mg及其化合物在生产、生活中有着广泛的应用,请按要求回答下列问题。
I. 用废铝渣制备Al(OH)3的流程如下图所示,假设反应①杂质不反应。

(1)Al在元素周期表中的位置为______,试剂X的名称______ 。
(2)溶液A显酸性的原因可能是(可用离子方程式表示) a.盐酸过量;b. ____________。
II.用镁硅酸盐矿石制备高纯度Mg(OH)2的流程如下图所示:

已知:①溶液M中除含Mg2+、SO42-外,还含少量Fe3+、 Al3+、Fe2+等离子;
②Mg2+与氨水的反应为吸热反应。
(1)向溶液M中先加入的试剂是_______;产生的沉淀有_____。H2O2参与反应的离子方程式是____________________。
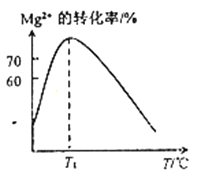
(2)溶液N中Mg2+的装化率随温度T的变化情况如图所示。T1之后,Mg,2+的转化率减小的原因是__________________。
-
Al、Mg及其化合物在生产、生活中有着广泛的应用,请按要求回答下列问题。
I.用废铝渣制备Al(OH)3的流程如下图所示,假设反应①杂质不反应。
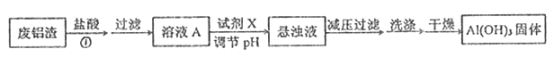
(1)Al在元素周期表中的位置为______,试剂X的名称______ 。
(2)溶液A显酸性的原因可能是(可用离子方程式表示) a.盐酸过量;b. ____________。
II.用镁硅酸盐矿石制备高纯度Mg(OH)2的流程如下图所示:
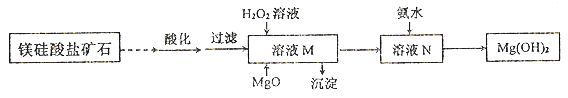
已知:①溶液M中除含Mg2+、SO42-外,还含少量Fe3+、 Al3+、Fe2+等离子;
②Mg2+与氨水的反应为吸热反应。
(1)向溶液M中先加入的试剂是_______;产生的沉淀有_____。
(2)H2O2参与反应的离子方程式是____________________。
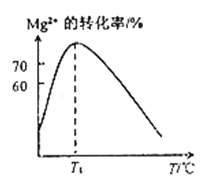
(2)溶液N中Mg2+的装化率随温度T的变化情况如图所示。T1之后,Mg,2+的转化率减小的原因是_________。
-
金属和非金属及其化合物在日常生产生活中有着广泛的运用,请回答下列问题:
(1)硅单质、硅的氧化物、硅酸盐产品在日常生活中广泛的运用:
①硅在周期表中的位置:
②硅酸钠是为数不多的溶于水的硅酸盐,硅酸钠显 性,向硅酸钠溶液中通入足量CO2有白色沉淀产生,写出该反应的离子反应方程式:
(2)铜不能与稀硫酸共热发生反应,但在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式: 。硫酸在该反应中表现的性质是
(3)纳米金属铁能高效地降解毒性强、难生物降解的有机卤化物,科技工作者利用Fe2O3和CH4在一定条件下制得纳米级单质铁,同时两种可燃性气体,则该反应的化学反应方程式为:
(4)Fe3O4是磁铁矿的主要成分,Fe3O4可用于制造录音磁带和电讯器材等。高温下,铝粉能与Fe3O4发生铝热反应,该反应的化学方程式为 。34.8g Fe3O4与足量稀硝酸反应,被还原HNO3的物质的量为 mol。
Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为 。

g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。













