-
能源是人类生存和发展的重要支柱。研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义。已知H2与CO反应生成CH3OH的过程如图所示:
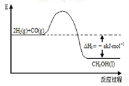
CO的燃烧热△H2=-bkJ·mol-1,CH3OH的燃烧热
△H3=-ckJ·mol-1。请根据以上信息,回答下列有关问题:
(1)甲醇是一种(填“可”或“不可”)再生能源,甲醇的官能团的电子式是 。
(2)CH3OH燃烧的热化学反应方程式为。
(3)H2的燃烧热△H=。
(4)一些化学键键能如下:C≡O为dkJ/mol;O=O为e kJ/mol;C=O为fkJ/mol。则由以上数据有b=
kJ/mol;C=O为fkJ/mol。则由以上数据有b=
(用d、e、f的代数式表示)。
(5)H2和CO的混合气体nmol,充分燃烧共放出QkJ热量,则混合气体中H2和CO的物质的量之比为。
(6)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的正极反应式。
-
能源是人类生存和发展的重要支柱.研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-bkJ•mol-1,CH3OH的燃烧热△H3=-ckJ•mol-1.请根据以上信息,回答下列有关问题:
(1)CH3OH燃烧的热化学反应方程式为______.
(2)H2的燃烧热为______.
(3)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol.则由以上数据有b=______(用d、e、f的代数式表示).
(4)H2和CO的混合气体nmol,充分燃烧共放出QkJ热量,则混合气体中H2和CO的物质的量之比为______.
(5)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的负极反应式______.
-
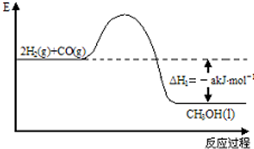
能源是人类生存和发展的重要支柱。研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义。已知H2与CO反应生成CH3OH的过程如图所示:

CO的燃烧热△H2=-b kJ/mol,CH3OH的燃烧热△H3=-c kJ/mol。请根据以上信息,回答下列有关问题:
(1)甲醇是一种______(填“可”或“不可”)再生能源,甲醇的官能团的电子式是____________。
(2)CH3OH燃烧热的热化学反应方程式为___________________________________。
(3)H2的燃烧热△H=_______________________。
(4)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol。则由以上数据算出b=_______(用d、e、f的代数式表示)。
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为____________,正反应放出的热量为__________________,CO的转化率为___________。
CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为____________,正反应放出的热量为__________________,CO的转化率为___________。
(6)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9kJ/mol,NO(g)+1/2O2(g)=NO2(g) ΔH=-58.2kJ/mol,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH=-241.6kJ/mol,反应3NO(g)+O3(g)==3NO2(g)的ΔH=________kJ/mol。
-
能源是人类生存和发展的重要支柱。研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义。
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g) =CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH=kJ/moL
(2)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
① 图中反应的ΔH=________kJ/mol(用含有E1、E2代数式表示)。
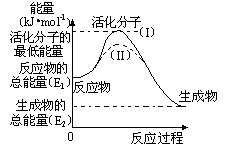
② 已知热化学方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=-241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为________kJ/mol。
③ 图中虚线(II)与实线(I) 对于同一反应具有的意义:
________ 。
-
能源是人类生存和发展的重要支柱.研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义.
(1)已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(g)△H=-241.8kJ/mol
O2(g)=H2O(g)△H=-241.8kJ/mol
②C(s)+ O2(g)=CO(g)△H=-110.5kJ/moL
O2(g)=CO(g)△H=-110.5kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO(g)△H=______kJ/moL
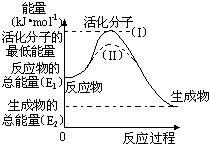
(2)研究活化能对于能源技术的革新有非常重大的实际意义.请认真观察下图,回答问题:
①图中反应的△H=______kJ/mol(用含有E1、E2代数式表示).
②已知热化学方程式:H2(g)+ O2(g)=H2O(g)△H=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则其逆反应的活化能为______kJ/mol.
O2(g)=H2O(g)△H=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则其逆反应的活化能为______kJ/mol.
③图中虚线(Ⅱ)与实线(Ⅰ)对于同一反应具有的意义:______.
-
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l) △H =-570kJ/mol ;
② H2(g)+1/2O2(g)=H2O(g) △H =-242kJ/mol ;
③ C(s)+1/2O2(g)=CO (g) △H = —110.5kJ/moL ;
④ C(s)+O2(g)=CO2(g) △H = —393.5kJ/moL;
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g) △H = +890kJ/moL
回答下列问题:
(1)上述反应中属于燃烧热的热化学方程式的是 。
(2)H2的燃烧热为 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。试写出碳与水蒸气反应的热化学方程式_ ;该反应的熵△S 0 (选填“>”、“=”、“<”);已知自由能△HG可推知该反应在______条件下可自发进行。
-
(8分)能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l)  H=-570kJ/mol ;② H2(g)+1/2O2(g)=H2O(g)
H=-570kJ/mol ;② H2(g)+1/2O2(g)=H2O(g)  H="-242kJ/mol"
H="-242kJ/mol"
③ C(s)+1/2O2(g)="CO" (g)  H=" —110.5kJ/moL" ④ C(s)+O2(g)=CO2(g)
H=" —110.5kJ/moL" ④ C(s)+O2(g)=CO2(g)  H="-393.5kJ/moL"
H="-393.5kJ/moL"
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g)  H=" +890kJ/moL"
H=" +890kJ/moL"
回答下列问题:
(1)上述反应中属于吸热反应的有(填写序号)________ 。
(2)H2的燃烧热为________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。 已知C(s) + H2O(g) = H2(g)+ CO (g)  H=akJ/moL;
H=akJ/moL;
则a=________; 又已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行________。
G<0时可自发进行。则该反应在什么条件下可自发进行________。
-
(4分)能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l) ;  H=-570 kJ·mol-1;
H=-570 kJ·mol-1;
② H2(g)+1/2O2(g)=H2O(g) ;  H=-242 kJ·mol-1
H=-242 kJ·mol-1
③ C(s)+1/2O2(g)=CO(g) ;  H= —110.5 kJ·mol-1
H= —110.5 kJ·mol-1
④ C(s)+O2(g)=CO2(g) ;  H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g) ; H= +890 kJ·mol-1
H= +890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是________
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+ CO (g)  H=a kJ·mol-1;则a=________;该反应的熵
H=a kJ·mol-1;则a=________;该反应的熵 S________0(选填“>”、“=”、“<”)。
S________0(选填“>”、“=”、“<”)。
-
能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l);△H=-570kJ•mol-1;
②H2(g)+1/2O2(g)=H2O(g);△H=-242kJ•mol-1
③C(s)+1/2O2(g)=CO(g);△H=-110.5kJ•mol-1
④C(s)+O2(g)=CO2(g);△H=-393.5kJ•mol-1
⑤CO2(g)+2H2O(g)=2CH4(g)+2O2(g);△H=+890kJ•mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是______
(2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然难直接测定,但可通过间接的方法求得.已知C(s)+H2O(g)=H2(g)+CO (g)△H=a kJ•mol-1;则a=______;该反应的熵△S______0(选填“>”、“=”、“<”).
-
能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l);△H=-570kJ/mol;
②H2(g)+ 2O2(g)=H2O(g);△H=-242kJ/mol
2O2(g)=H2O(g);△H=-242kJ/mol
③C(s)+ O2(g)=CO(g);△H=-110.5kJ/moL
O2(g)=CO(g);△H=-110.5kJ/moL
④C(s)+O2(g)=CO2(g);△H=-393.5kJ/moL
⑤CO2(g)+2H2O(g)=2CH4(g)+2O2(g);△H=+890kJ/moL
回答下列问题:
(1)上述反应中属于吸热反应的是______
(2)H2的燃烧热为______.
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然难直接测定,但可通过间接的方法求得.已知C(s)+H2O(g)=H2(g)+CO (g)△H=akJ/moL;则a=______;该反应的熵△S______ 0(选填“>”、“=”、“<”).

CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为____________,正反应放出的热量为__________________,CO的转化率为___________。



