-
(1)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2===4CuSO4+2H2O,该反应的还原剂是________________。当1 mol O2发生反应时,还原剂所失电子的物质的量为_________mol。
(2)焙烧明矾的化学方程式为4KAl(SO4)2·12H2O+3S===2K2SO4+2Al2O3+9SO2+48H2O,在该反应中,还原剂是_____________。
(3)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________。
(4)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:

向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_________________;该操作将I2还原为I-的目的是________________________。
(5)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是________________。

(6)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为________________,反应消耗1 mol NaBH4时转移的电子数目为_____________。
-
金属冶炼与处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是________。当1 mol O2发生反应时,还原剂所失电子的物质的量为________mol。向CuSO4溶液中加入镁条时有气体生成,该气体是________。
(3)如图为电解精炼银的示意图,________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为__________________________。

(4)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用是______________________________________________。
-
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是__________
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2 H2O,当1mol O2发生反应时,还原剂所失电子的物质的量为___mol。向CuSO4溶液中加入镁条时有气体生成,该气体是____。
(3)右图为电解精炼银的示意图,_____(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为____________。
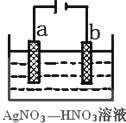
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为_____________________________。
-
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是__________
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是______,当1mol O2发生反应时,还原剂所失电子的物质的量为____mol。向CuSO4溶液中加入镁条时有气体生成,该气体是______。
(3)右图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为____________。
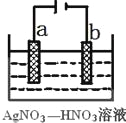
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为_________。
-
(12分)金属冶炼和处理常涉及许多反应。
(1)由下列物质冶炼相应金属时采用电解法的是______
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S + 2H2SO4 + 5O2 = 4CuSO4 + 2H2O,该反应的还原剂是______,当1molO2发生反应时,还原剂所失电子的物质的量为______mol。
(3)图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。
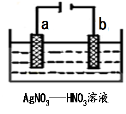
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 ,其总反应式为: 。
(5)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)
已知:①FeO(s) + CO(g) = Fe(s) + CO2(g) △H1=-11KJ/mol
②3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H2=-47KJ/mol
③Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) △H3=+19KJ/mol
则反应Fe2O3(s) + 3CO(g)= 2Fe(s)+ 3CO2(g)的△H= 。
-
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ•mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ•mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=________.
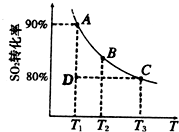
(2)硫酸生产中涉及反应:2SO2(g)+O2(g)⇌2SO3(g).
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H________O(填“>”或“<”).反应进行到状态D时,v正________v逆(填“>”、“<”或“=”).
②某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol•L-1,则0~10min内的平均反应速率v(SO2)=________,该温度下反应的平衡常数K=________.
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)________
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
④以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是________
A.向容器中通入少量O2 B.向容器中通入少量SO2C.使用催化剂 D.升高温度E.恒容通入少量氦气
⑤气体SO2是大气污染物,可选用下列试剂中的________吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨.
-
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+5O2,下列说法正确的是( )
A.SO2既是氧化产物又是还原产物
B.CuFeS2仅作还原剂,硫元素被氧化
C.每生成lmolCu2S,有4mol硫被氧化
D.每转移1.2mol电子,有0.3mol硫被氧化
-
黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S + 3O2 →2Cu2O + 2SO2……① 2Cu2O + Cu2S →6Cu + SO2……②。则下列说法正确的是
A.反应②中Cu2S只发生了氧化反应
B.反应①中氧化产物只有SO2
C.若1molCu2S完全转化为2molCu,则转移电子数为2NA
D.将1molCu2S冶炼成2molCu,需要O2 1mol
-
黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S + 3O2 →2Cu2O + 2SO2……① 2 Cu2O + Cu2S →6Cu + SO2……②。则
A.反应①中还原产物只有SO2
B.反应②中Cu2S只发生了氧化反应
C.将1 molCu2S冶炼成 2mol Cu,需要O2 1mol
D.若1molCu2S完全转化为2molCu,则转移电子数为2NA
-
辉铜矿(主要成分是Cu2S)含铜量高,是最重要的炼铜矿石。
I.已知: ①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2 kJ.mol-1
②Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=-217.4kJ.mol-1
(1)Cu2S与Cu2O反应生成Cu 和SO2 的热化学方程式为_____________。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反应①:CH3OCH3(g)+CO(g) CH3COOCH3(g) △H1
CH3COOCH3(g) △H1
反应②:CH3COOCH3(g)+2H2(g) CH3OH(g)+C2H5OH(g) △H2
CH3OH(g)+C2H5OH(g) △H2
(2)压强为pkPa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图1所示,则△H1____(填“>”或“<”,下同)0、△H2_____0。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示。在300~600K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是____________。

(3)若压强为pkPa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3 和1molCO发生反应①,2 min时达到平衡,则前2 min内CH3COOCH3 的平均生成速率为_________,该条件下平衡常数K=_____________。
(4)以铜为原料,利用电解法可制取具有广泛用途的光电材料——纳米Cu2O,其工作原理如图3所示。则b是_______极,电解时阳极的电极反应式为______________。








