-
一瓶未知溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是_________;肯定没有的离子是_______________。
【答案】H+、Ba2+、I-、NH4+ CO32-、SO42-、Mg2+、Fe3+
【解析】
由(1)知溶液中存在H+离子,无CO32-离子;由(2)知溶液中存在I-离子、无Fe3+离子;由(3)知溶液中无Mg2+离子;由(4)知溶液中有Ba2+离子,无SO42-离子;由(5)知溶液中存在NH4+离子。综上可知溶液中一定含有的离子为H+、NH4+、Ba2+、I-,一定不含有的离子为CO32-、Mg2+、Fe3+、SO42-,可能含有的离子为Na+、K+、Cl-。
【点睛】
本题考查了常见的离子检验方法,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析。
【题型】填空题
【结束】
28
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
-
某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-、CO32-。取该溶液进行如下实验:
①取溶液少许,滴入AgNO3溶液产生白色沉淀;
②另取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解;
③另取原溶液500mL,加入过氧化钠固体,产生的沉淀的物质的量与加入过氧化钠的物质的量的关系如下图所示。
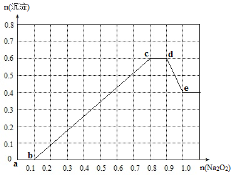
根据实验现象和数据分析,回答下列问题:
(1)de段发生的反应的离子方程式是 ;
(2)溶液中肯定存在的离子是 (用离子符号表示);
(3)溶液中可能存在的离子是 (用离子符号表示);
(4)原溶液中金属阳离子的浓度分别为 ;
(5)请在答题卡对应图上画出加入过氧化钠从0~1.1mol时,产生气体的物质的量随加入过氧化钠物质的量变化的曲线(假设生成的气体全部逸出)。
-
(10分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。你取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;根据上述实验事实,你可知道该溶液中肯定含有的离子是①;肯定不存在的离子是② ________;还不能确定是否存在的离子是③ ________。
-
有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42―、CO32―、Cl―和I―。你取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;
根据上述实验事实,你可知道该溶液中肯定含有的离子是①_______________;肯定不存在的离子②____________;还不能确定是否存在的离子是③_________,若要确定其中的阳离子可采用的方法④____________;写出第(2)步骤中的离子方程式是⑤____________________;第(5)步骤中得到的气体化学键类型是⑥_________________;
-
有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42―、CO32―、Cl―和I―。取该溶液进行了以下实验:(1)用pH试纸检验,表明溶液呈强酸性;(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝。根据上述实验事实填空:
①该溶液中肯定含有的离子是____________________________;
②还不能确定是否存在的离子是 _________________________;
③请写出检验Cl―的方法_____________________。
-
有一瓶澄清的溶液,其中可能含有H+、NH4+、K+、Al3+、Mg2+、Ba2+、Fe3+、SO42-、CO32-和I-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈酸性;
②取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
③另取部分溶液,加入稀NaOH溶液使其变为碱性,溶液中始终无沉淀生成;
④取部分上述碱性溶流,加Na2CO3溶液有白色沉淀生成;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝。
(1)根据上述实验事实,该溶液中肯定存在的离子是_________;肯定不存在的离子是______。
(2)对于不确定是否存在的离子,应用___________方法进行检验。
(3)实验②中发生反应的离子方程式为____________________。
(4)实验④中发生反应的离子方程式为____________________。
-
有一澄清溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42﹣、CO32﹣、NO3﹣、Cl﹣、I﹣现进行如下实验:
(1)测知溶液显强酸性;
(2)取样加少量CCl4和数滴新制氯水,CCl4层为紫红色;
(3)另取样滴加稀NaOH溶液,使溶液变为碱性,此过程中均无沉淀生成;
(4)取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
(5)将实验(3)中的碱性溶液加热,有气体放出,该气体能使湿红色石蕊试纸变蓝.
则可推知:
①原溶液中肯定存在的离子是______________;
②不能确定是否存在的离子是______________.
-
实验探究和推理都是科学研究的基本方法,请你对以下实验进行探究和推理:有一瓶澄清的溶液,其中可能含有H+、NH4+、Na+、Mg2+、Ba2+、Fe3+、SO42﹣、CO32﹣和I﹣。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体(摩尔质量为17g/mol)能使润湿的红色石蕊试纸变蓝,根据上述实验事实,你可知道该溶液中肯定含有的离子是①_______________;还不能确定是否存在的离子是②______,为确定该离子是否存在,可以通过_______________证明该离子的存在。(填写实验方法)
-
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl﹣、CO32﹣、SO42﹣,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲;在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g.
第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.{已知:NaAlO2+2H2O+CO2═NaHCO3+Al(OH)3↓}.根据上述实验回答:
(1)一定不存在的离子是____________,不能确定是否存在的离子是____________.
(2)试确定溶液中肯定存在的离子及其浓度:
离子符号_________,浓度________________;
离子符号_________,浓度________________;
离子符号_________,浓度________________.
(3)试确定K+是否存在________,判断的理由是________________________________
-
Ⅰ. 有一瓶澄清溶液,可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl―、I―现进行如下实验:
①测知溶液显强酸性;②取样加少量CCl4和数滴新制氯水,CCl4层为紫红色;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程中均无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润红色石蕊试纸变蓝。
请回答:(1)原溶液中肯定存在的离子是____________________
(2)不能确定是否存在的离子是____________________
Ⅱ. (1)某兴趣小组同学汲取热电厂附近的雨水进行实验。雨水样品在空气中放置2小时后,通过测定发现雨水样品的酸性会增强,你认为会形成溶液酸性这一变化的原因是(用离子方程式表示)________________________________________________
(2)正常雨水的溶液也是偏酸性,这是因为_____________________________________
(3)该兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气 、氧气 、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Cl2+H2O=2HCl+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。计算该空气样品中二氧化硫的体积分数_____________________

