-
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为0.16 mol·L-1的CuSO4溶液。
①配制950 mL 0.16mol·L-1的CuSO4溶液应称取胆矾的质量为________g。
②某学生实际配制CuSO4溶液的浓度为0.18 mol·L-1,原因可能是________。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时俯视刻度
(2)写出用上述方法制备CuCl的离子方程式_______________________________。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。其中“于70 ℃真空干燥”的目的是____________; ______________________ (回答两点)。
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2===CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是________。
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.1 mol O2 参加反应有1 mol电子发生转移 D.Cu被氧化
高一化学综合题困难题查看答案及解析
-
氯化亚铜(CuCl)是一种白色粉末,不溶于水、乙醇(标准状况下沸点是78.2℃)及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用于有机合成工业中的催化剂。以粗盐水(含氯化钙、硫酸镁等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
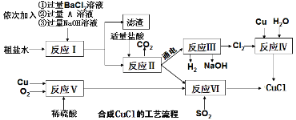
(1)A溶液中溶质的化学式是__________ ;
(2)写出反应V的化学方程式 _______________ ;
(3)反应VI的化学方程式是:2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4,反应中化合价升高的元素是___;
(4)本工艺中可循环利用的物质是NaOH和_____;
(5)反应VI后,过滤得到的CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却密封包装即得产品。真空干燥的目的是_______________。
高一化学综合题中等难度题查看答案及解析
-
氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜(主要成分是Cu,含有少量CuO)为原料生产CuCl,其工艺流程如下
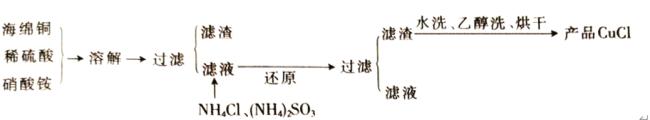
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:_________
Cu+ NO3-+ = Cu2++ NO↑+ H2O
(2)“还原”过程中,作还原剂的是__________(填化学式);写出“还原”过程中发生反应的离子方程式:__________________________________。
(3)写出CuCl在潮湿的空气中被氧化的化学方程式:__________________________。
(4)析出的CuCl晶体水洗后要立即用无水酒精洗涤,并在真空干燥机内于70℃下干燥2h,冷却密封包装。密封包装的原因是_____________________________。
高一化学工业流程中等难度题查看答案及解析
-
氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜(主要成分是 Cu,含有少量CuO)为原料生产CuCl,其工艺流程如下:
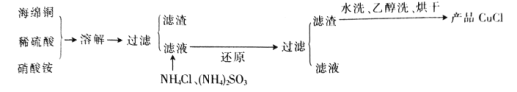
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:
____Cu+___+____
= _____Cu2++____ NO↑ +___H2O
(2)还原“”过程中,作还原剂的是_________(填化学式);写出“还原”过程中发生反应的离子方程式:_________。
(3)写出氯化亚铜在潮湿的空气中被氧化的化学方程式: ______。
(4)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,并在真空干燥机内于70℃下干燥2 h,冷却密封包装。密封包装的原因是______。
高一化学工业流程中等难度题查看答案及解析
-
CuBr(溴化亚铜)是一种白色固体,不溶于水,在空气中会慢慢被氧化成绿色粉末,常用作催化剂,可用下图所示实验制得。
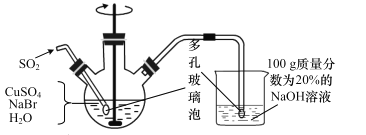
三颈烧瓶中的反应为 2Cu2++SO2+2Br-+2H2O=2CuBr↓+SO42-+4H+。
(1)实验所用蒸馏水需煮沸,目的是_______________。装置中使用多孔玻璃泡的目的是___________。
(2)将反应后得到的 CuBr 过滤并洗涤,检验 CuBr 是否洗净的方法是______。
(3)烧杯中若 NaOH 的量不足,则烧杯中最终所得溶液中的溶质是__________。
(4)CuBr 在空气中氧化所得绿色粉末为 xCuBr2·yCu(OH)2,为探究该粉末的化学式, 现进行如下实验:准确称取一定质量的绿色粉末,溶于足量乙酸中,用蒸馏水配制成 100 mL 溶液。
①取 25 mL 溶液,向其中加入足量的 AgNO3 溶液,充分反应后过滤、洗涤、干燥, 所得淡黄色固体质量为 0.94 g。
②另取 25 mL 溶液,向其中加入过量的 KI 溶液,再用 0.400mol·L-1Na2S2O3 标准溶液滴定至终点,消耗 25.00 mL。已知反应过程中的方程式如下:2Cu2++4I﹣=2CuI↓+I2、2S2O32-+I2=2I﹣+S4O62﹣。请确定该绿色粉末的化学式_________(需要计算过程)。
高一化学实验题中等难度题查看答案及解析
-
某实验小组采用刻蚀废液(主要含CuCl2、FeCl3、FeCl2、HCl)制取Cu和Cu2Cl2,实验流程如下:
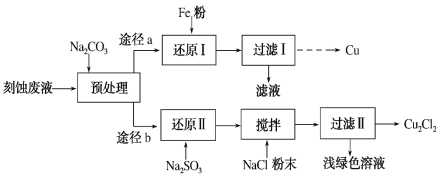
已知:Cu2Cl2是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。
(1)“预处理”时,需用Na2CO3调节溶液至微酸性而不是碱性,其原因是__________________。
(2)“还原Ⅰ”需在80 ℃条件下进行,适宜的加热方式为____________。
(3)“还原Ⅱ”中,Cu2+参与反应的离子方程式为__________________。
(4)“搅拌”时加入NaCl粉末的作用是____________________________。
(5)“过滤Ⅱ”得到的Cu2Cl2需用无水乙醇洗涤,并在真空干燥机内于70 ℃干燥2小时,冷却,密封包装。于70 ℃真空干燥的目的是__________________________。
(6)①设计从“过滤Ⅰ”所得滤渣中获取Cu的实验方案:稀硫酸加到滤渣中,搅拌,充分反应至无气体产生为止,过滤并用蒸馏水洗涤2~3次,低温烘干。
②现欲测定途径a、b回收铜元素的回收率比,请补充实验方案:____________________,分别按途径a、b制取Cu和Cu2Cl2,测得Cu的质量为m1 g,Cu2Cl2的质量为m2 g,则途径a、b铜元素的回收率比为________(铜元素回收率=产品中铜元素质量/废液中铜元素的质量×100%)。
高一化学实验题中等难度题查看答案及解析
-
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程图.请回答以下问题:
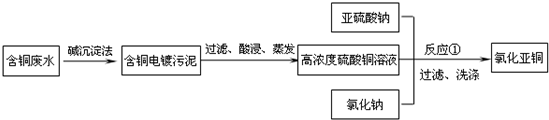
(1)写出反应①制备氯化亚铜的离子反应方程式:________.
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5.这样做的目的是________.
(3)右图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在________
时,CuCl产率能达到94%.随后随温度升高CuCl产率会下降,其原因是________.
(4)若要提高CuCl的产率你认为还可采取的措施有________.
高一化学填空题中等难度题查看答案及解析
-
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程图.请回答以下问题:
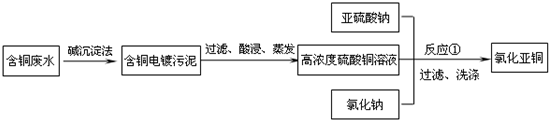
(1)写出反应①制备氯化亚铜的离子反应方程式:________.
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5.这样做的目的是________.
(3)右图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在________
时,CuCl产率能达到94%.随后随温度升高CuCl产率会下降,其原因是________.
(4)若要提高CuCl的产率你认为还可采取的措施有________.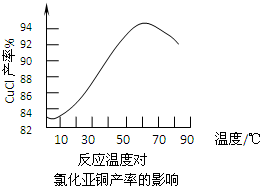
高一化学填空题中等难度题查看答案及解析
-
氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC12•2H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
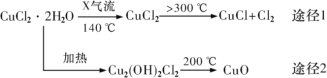
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl2•2H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
高一化学单选题中等难度题查看答案及解析
-
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设: 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验: 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN试剂。
(1)若假设1成立,则实验现象是_______________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________简述你的理由(不需写出反应的方程式)____________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是__________,写出发生反应的离子方程式______、__________、______________。
探究延伸:
(4)如果经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。某实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为__________。
高一化学实验题困难题查看答案及解析