-
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物),冬季空气污染严重也跟冬季燃煤密切相关。
SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是______(填字母)。
a.PM2.5在空气中一定能形成气溶胶
b.PM2.5比表面积大能吸附大量的有毒有害物质
c.PM2.5 主要来源于直接排放的工业污染物和汽车尾气等
d.酸雨、臭氧层破坏等环境问题与PM2.5无关
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ•mol-1
CH3OH(g)+H2O(g) △H=-a kJ•mol-1
2H2(g)+O2(g)=2H2O(g) △H=-b kJ•mol-1
H2O(g)-H2O(l) △H=-c kJ•mol-1
CH3OH(g)=CH3OH(l) △H=-d kJ•mol-1
则表示CH3OH(l)燃烧热的热化学方程式为________________________________。
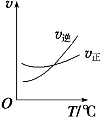
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
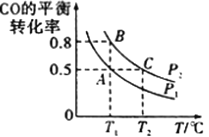
①下列说法不能判断该反应达到化学平衡状态的是______(填字母)。
a.H2的消耗速率是CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA_____ PB (填“>”、“<”或“=”)。
③若达到化学平衡状态A时。容器的体积为20L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=____________L。
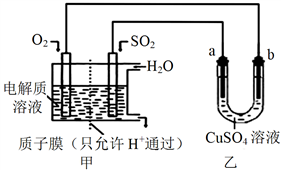
(4)SO2在一定条件下可与氧气构成原电池。右图是利用该电池在铁表面镀铜的装置示意图:
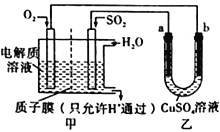
①该电池的负极反应:__________________________________;质于膜(只允许H通过)
②当甲中消耗2.24 LO2(标准状况)时,乙中__________(填“a”或“b”)增重_________g。
-
(15分)燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C
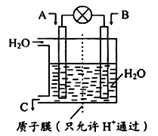
若A为SO2,B为O2,则负极的电极反应式为:________________________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
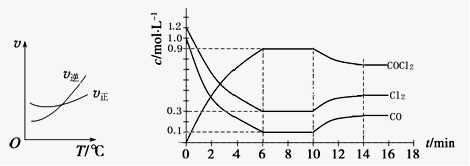
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
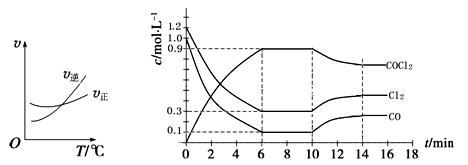
① 0~6 min内,反应的平均速率v(Cl2)= ;
② 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③ 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反 应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④ 随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)______________T(15)(填“<”、“>”或“=”)。
-
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中固定体积容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中固定体积容器内各物质的浓度随时间变化的曲线。回答下列问题:
① 0~6 min内,反应的平均速率v(Cl2)= ;
②下列说法不能判断该反应达到化学平衡状态的是 。(填字母)
A.体系中Cl2的转化率不变
B.体系中气体的平均摩尔质量不再改变
C.每消耗1mol CO的同时生成1mol COCl2
D.混合气体密度不变
③随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
④比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8) T(15)
(填“<”、“>”或“=”)。
⑤若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡
移动(填“向正反应方向”、“向逆反应方向”或“不”);
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)如图所示,利用电化学原理将SO2 转化为重要化工原料C

若A为SO2,B为O2,则负极的电极反应式为:________________________;
-
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
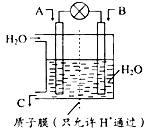
(1)利用电化学原理将SO2 转化为重要化工原料C若A为SO2,B为O2,则负极的电极反应式为:________。
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-b kJ•mol-1;
H2O(g)═H2O(l)△H=-c kJ•mol-1;
CH3OH(g)═CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:________。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| | | | | | |
①该反应的△H________(填“>”或“<”)热反应,实验2条件下平衡常数K=________
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值________(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正________V逆(填“<”,“>”,“=”)。
④判断该反应达到平衡的依据是________。
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.容器中气体的平均相对分子质量不随时间而变化
-
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
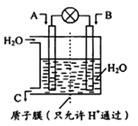
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:___________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组om] | 温度℃ | 起始量/mol[ | 平衡量/mol | 达到平衡所需 时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| | | | | | |
①实验2条件下平衡常数K=________,该反应的ΔH________0 (填“>”或“<”)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则b/a 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V逆 V正(填“<” ,“>” ,“=”)。
④判断该反应达到平衡的依据是________。
A.CO2减少的化学反应速率和CO减少的化学反应速率相等 B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等 D.容器中气体的平均相对分子质量不随时间而变化
-
燃煤能排放大量的 CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2 也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是(______)
a.PM2.5空气中形成了胶体
b.PM2.5表面积能大面积吸附大量的有毒有害物质
c.机动车尾气排放等过程中经过燃烧而排放的残留物,大多还有重金属等有毒物质
d.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-b kJ·mol-1;
H2O(g)= H2O(l) △H=-c kJ·mol-1;
CH3OH(g)= CH3OH(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为________________________。
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g)  CH3OH(g)。在一容积可变的密闭容器中充入 10mol CO 和 20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入 10mol CO 和 20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示。
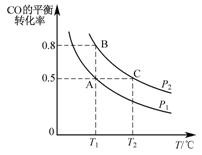
①下列说法不能判断该反应达到化学平衡状态的是_________(填字母)。
a.H2 的消耗速率等于 CH3OH 的生成速率的 2 倍
b.H2 的体积分数不再改变
c.体系中 H2 的转化率和 CO 的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较 A、B 两点压强大小 PA__________PB(填“>”“<”或“=”)。
③若达到化学平衡状态 A 时,容器的体积为 20 L。如果反应开始时仍充入 10 mol CO 和 20 mol H2,则在平衡状态 B 时容器的体积 V(B)=____L。
(4)SO2 在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:

①该电池的负极反应:______________________________;
②当甲中消耗2.24 L O2(标准状况)时,乙中_____(填“a”或“b”)增重_______g。
-
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。

如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:______________________________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-b kJ·mol-1;
H2O(g)=H2O(l) △H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_________________________________;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g) +CO(g) COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
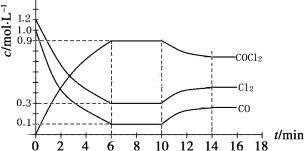
0~6 min内,反应的平均速率v(Cl2)= ;
若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向 正反应方向”、“向逆反应方向”或“不”);
若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)________T(15) (填“<”、“>”或“=”)。
-
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
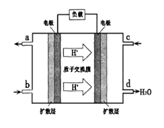
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
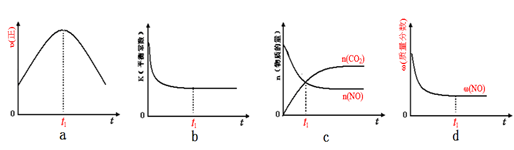
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。
(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
-
(13分)PM2.5污染跟工业燃煤密切相关,燃煤还同时排放大量的SO2和NOX。
(1)在一定条件下,SO2气体可被氧气氧化,每生成8 g SO3气体,放出9.83 kJ的热量,写出该反应的热化学方程式 。若起始时向密闭容器内充入0.4mol SO2和0.2mol O2,达平衡后放出的热量为Q,则Q 39.32kJ(填“>”、“<”或“=”).
(2)一定条件下,在恒容密闭的容器中,当上述反应达到平衡时,下列说法正确的是__________(填序号)
a.2v逆(SO2)=v正(O2)
b.ΔH保持不变
c.混合气体密度保持不变
d.混合气体的平均相对分子质量保持不变
(3)500℃时,在催化剂存在条件下,分别将2 mol SO2和1 mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同,),充分反应均达到平衡后,两容器中SO2的转化率关系是I_________II(填“>”、“<”或“=”)。若测得容器II中的压强减小了30%,则该容器中SO3体积分数为 (结果保留3位有效数字)。
(4)将生成的SO3溶于水,再向溶液中通入NH3得到1L cmol/L(NH4)2SO4溶液的PH=5,计算该(NH4)2SO4溶液的水解平衡常数Kh= 。
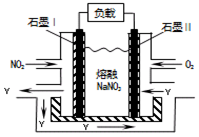
(5)NO2、O2和熔融NaNO3可制作原电池,其装置见下图。该电池中Na+向 _____ 电极移动(填“Ⅰ”或“Ⅱ”),在电池使用过程中石墨I电极上生成氧化物Y,其电极反应为 。
-
燃煤排放大量的 CO、CO2、SO2,PM2.5(可入肺颗粒物)对环境有较大影响,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的有害颗粒,下列有关说法中正确的是(___)
a.PM2.5在空气中形成了胶体
b.PM2.5表面积能大面积吸附大量的有毒有害物质
c.机动车尾气排放等过程中经过燃烧而排放的残留物,含有重金属等有毒物质
(2)已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-b kJ·mol-1;
CH3OH(g)= CH3OH(l) △H=-c kJ·mol-1,
则表示CH3OH(l)燃烧生成CO2(g)和H2O(g)的热化学方程式为________________。
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g)  CH3OH(g)。在一容积可变的密闭容器中充入 10mol CO 和 20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入 10mol CO 和 20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示。
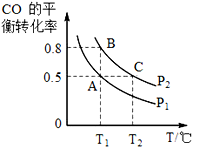
①比较 A、B 两点压强大小 PA__________PB(填“>”“<”或“=”)。
②T1温度下,若达到化学平衡状态 A 时,容器的体积为 20 L,该温度下该反应的平衡常数为K=______________。如果反应开始时仍充入 10 mol CO 和 20 mol H2,则在平衡状态 B 时容器的体积 V(B)=____________________L。
(4)SO2 在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:
①该电池的负极反应:______________;
②当甲中消耗2.24 L O2(标准状况)时,乙中_____(填“a”或“b”)增重_______g。

CH3OH+H2O
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
















