-
目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化成SO42-。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

①其中: 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
②酸性KMnO4溶液体积为200 mL,浓度为0.1 mol·L-1。
回答下列问题:
(1)配制200 mL 0.1 mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有________、________、________、玻璃棒、________、________。玻璃棒的作用是
____________________________________________________________。
(2)写出并配平测定SO2含量的离子方程式:_______________________________________。
(3)实验中棉花的作用是_____________________________________________________;
若要测定空气中可吸入颗粒的含量(g·L-1),还需要测出的数据是________。
(4)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):____________________________________________________。
-
某研究性学习小组的同学拟分析某市空气的质量情况,测定该市空气中SO2的含量并制定下列研究方案:
Ⅰ.已知:SO2与酸性KMnO4溶液(Mn2+在溶液中近无色)发生反应:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
Ⅱ.设计实验方案:利用SO2的还原性使SO2和已知浓度及体积的酸性KMnO4溶液反应进行定量分析.
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽.
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后.
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议.
请你参与该研究性学习小组的活动并发表你的见【解析】
(1)该小组的同学拟用下列装置定量分析空气中SO2的含量:

①通入空气前应进行的实验操作是______;
②当看到实验的现象为______时,应停止通空气.
③实验过程中需测量并记录的数据:______.
(2)图是该小组同学根据实验测得的县城不同地区空气中SO2含量:
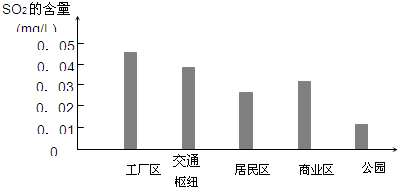
①工厂区、交通枢纽SO2含量明显高于其他地区的原因是______;
②请你向当地有关部门提出一条减少厂区SO2排放的建议______.
(3)下表是该小组同学测得的不同天气情况下的县城空气中SO2的平均含量.请你分析雨后或风速较大时SO2平均含量较低的原因:
| 天气情况 | 平均风速(m/s) | 空气中SO2的平均含量(mg/L) |
| 雨 前 | 2.0 | 0.03 |
| 雨 后 | 2.2 | 0.01 |
| 晴 | 23 | 0.015 |
| 晴 | 0.9 | 0.03 |
①:______;
②:______.
-
亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(反应方程式为2NO+Na2O2=2NaNO2,部分夹持装置和A中加热装置已略)
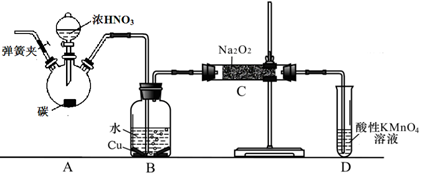
(1)写出装置A烧瓶中发生反应的化学方程式________。
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是________(填字母)。
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(3)第一组实验数据出现异常,造成这种异常的原因可能是________(填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数。
(5)亚硝酸钠易溶于水,将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为________。
探究三 反应废液的处理
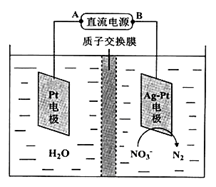
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的pH由7变为12。电化学降解NO3-的原理如右图所示。
(6)电源正极为________(填A或B),阴极反应式为________。
-
某实验小组为了分析补血剂 FeSO4·7H2O 中铁元素的质量分数,用 KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4- +8H+= 5Fe3++Mn2++4H2O。
(1)实验前,首先要精确配制一定物质的量浓度的 KMnO4 溶液 250 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、胶头滴管外,还需____________。
(2)滴定前是否要滴加指示剂?_____(填“是”或“否”),理由是_____。
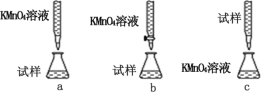
(3)某同学设计的下列滴定方式中,最合理的是_____(填序号)
(4)该实验小组称取 12.0 g 补血剂在容量瓶中配成 100 mL 溶液,量取 25.00 mL 试样溶液, 用 0.100 mol·L-1 KMnO4标准溶液滴定。 达到滴定终点时, 消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是_____(精确至 0.01%)。
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量 仍偏小,其可能原因是_____。
-
我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组欲利酸性KMnO4溶液测定空气中甲醛的含量, (部分装置如图),其反应原理及步骤如下:
4MnO4-+5HCHO+H +=Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
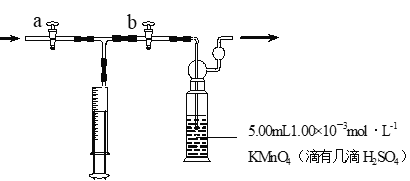
步骤:①量取5.00mL 1.00×10-3mol·L-1 KMnO4,溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②取1.00×10-3mol·L-1草酸标准溶液于酸式滴定管中备用。
③用注射器抽取100mL新装修室内空气。再将注射器气体推入洗气瓶中充分反应。再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液5.00mL)。3次实验消耗草酸溶液的体积平均值为12.38mL。
回答下列问题
(1)此实验用指示剂____________(填字母)。A 甲基橙 b酚酞 c淀粉 d无需另外添加试剂
(2)量取5.00mL KMnO4溶液应用______________滴定管
(3)下列操作能引起室内甲醛浓度偏高的是________。
a.滴定终点俯视读数 b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水 d.装草酸的滴定管未润洗
(4)草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,如果向10 mL 0.01 mol•L-1 H2C2O4溶液中滴加0.0 1 mol•L-1 NaOH溶液
①当加入的NaOH溶液体积为10 mL,请你写出溶液中质子守恒关系式__________。
②当加入的NaOH溶液体积为20 mL,请你写出溶液中离子的浓度大小关系__________。
-
我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组欲利酸性KMnO4溶液测定空气中甲醛的含量, (部分装置如图),其反应原理及步骤如下:
4MnO4-+5HCHO+H +=Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
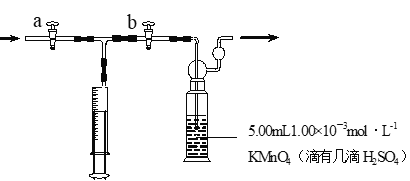
步骤:①量取5.00mL 1.00×10-3mol·L-1 KMnO4,溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②取1.00×10-3mol·L-1草酸标准溶液于酸式滴定管中备用。
③用注射器抽取100mL新装修室内空气。再将注射器气体推入洗气瓶中充分反应。再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液5.00mL)。3次实验消耗草酸溶液的体积平均值为12.38mL。
回答下列问题
(1)此实验用指示剂____________(填字母)。A 甲基橙 b酚酞 c淀粉 d无需另外添加试剂
(2)量取5.00mL KMnO4溶液应用______________滴定管
(3)下列操作能引起室内甲醛浓度偏高的是________。
a.滴定终点俯视读数 b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水 d.装草酸的滴定管未润洗
(4)草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,如果向10 mL 0.01 mol•L-1 H2C2O4溶液中滴加0.0 1 mol•L-1 NaOH溶液
①当加入的NaOH溶液体积为10 mL,请你写出溶液中质子守恒关系式__________。
②当加入的NaOH溶液体积为20 mL,请你写出溶液中离子的浓度大小关系__________。
-
我国规定:室内甲醛含量不得超过0.08mg•m﹣3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务(部分装置如图),其反应原理及步骤如下:
4MnO4﹣+5HCHO+H+═Mn2++5CO2↑+11H2O
2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
步骤:①量取5.00mL 1.00×10﹣3mol•L﹣1 KMnO4,溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②取1.00×10﹣3mol•L﹣1草酸标准溶液于酸式滴定管中备用。
③用注射器抽取100mL新装修室内空气,再将注射器气体推入洗气瓶中充分反应,再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液5.00mL),3次实验消耗草酸溶液的体积平均值为12.38mL。
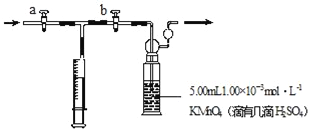
回答下列问题
(1)5.00mL高锰酸钾用_____量取。
(2)此实验用指示剂_____(填字母)。
a甲基橙 b酚酞 c淀粉 d无需另外添加试剂
(3)计算该居室内空气中甲醛的浓度_____mg•m﹣3。
(4)下列操作能引起室内甲醛浓度偏高的是_____。
a.滴定终点俯视读数
b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水
d.装草酸的滴定管未润洗
(5)草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,如果向10 mL 0.01mol•L﹣1H2C2O4溶液中滴加0.01 mol•L﹣1NaOH溶液
①当加入的NaOH溶液体积为10mL,请你写出溶液中质子守恒关系式_____。
②当加入的NaOH溶液体积为20mL,请你写出溶液中离子的浓度大小关系_____。
-
草酸溶液能使酸性KMnO4溶液褪色,其离子方程式为:
MnO4-+H2C2O4+H+→CO2↑+Mn2++__(未配平)。关于此反应的叙述正确的是
A.该反应的还原产物是CO2
B.该反应右框内的产物是OH-
C.配平该反应后,H+计量数是6
D.1molMnO4-在反应中失去5mol电子
-
羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原.25.00ml0.5mol/L羟胺的酸性溶液能与50ml0.25mol/LKMnO4酸性溶液完全作用(已知MnO4﹣被还原为Mn2+)则上述反应中羟胺的氧化产物是
A. N2 B. N2O C. NO D. NO2
-
NaNO2是一种食品添加剂,它能致癌.酸性KMnO4溶液与NaNO2的反应方程式是:MnO4-+NO2-+H+→Mn2++NO3-+H2O(未配平)。下列叙述中正确的是( )
A.该反应中NO2-是还原剂
B.反应过程中溶液的pH减小
C.生成1mol NaNO3时消耗0.4mol KMnO4
D该反应可说明氧化性MnO4-<NO3-

或
表示密闭容器;
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。







