-
碱式碳酸铜(Cu2(OH)2CO3)是名贵的矿物宝石孔雀石的主要成分,应用广泛,如在无机工业中用于制造各种铜化合物,有机工业中用作有机合成催化剂等等,某化学小组为了探究碱式碳酸铜生成条件对其产率的影响,设计了如下实验:
设计原理:取一定体积的碳酸钠溶液(0.5mol/L)于100mL烧杯中,进行加热,恒温后将硫酸铜溶液(5.00mL. 0.5mol/L)在不断搅拌下以一定速度逐滴加入到上述碳酸钠溶液中,反应达平衡后,静止,减压过滤,洗涤,烘干,即得到最终产品,同时有气体放出。
(1)反应原理为:________________。
(2)探究反应原料用量比对反应产物的影响。
该化学小组根据所提供试剂设汁两个实验来说明反应原料用量对产品的影响
提供试剂:0.5mol/LNa2CO3溶液、0.5mol/LCuSO4溶液。
①请填写下表的空白处:
| ① | ② | ③ | ④ |
| 硫酸铜溶液体积/mL | 2.0 | 2.0 | 2.0 | 2.0 |
| 碳酸钠溶液体积/mL | 1.6 | 2.0 | | 2.8 |
| Na2CO3/CuSO4mol/比) | 0.8 | 1 | | 1.4 |
②通过实验画图可知:当比值为______,碱式碳酸铜产量最好。
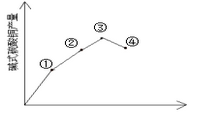
(3)反应温度对产率的影响
在三支试管中各加入2.0mL0.5 mol/LCuSO4溶液另取四支试管各加入由上述实验得到的合适用量的0.5 mol /L Na2CO3溶液。从这两列试管中各取一支将它们分別置于室温、30℃、50℃、100℃的环境中数分钟后将CuSO4溶液倒入Na2CO3溶液中振荡并观察现象,发现:沉淀颜色分别为蓝色沉淀,绿色沉淀、深绿色沉淀,绿色中带有黑色沉淀,实验结果也如上图所示,请思考,为什么温度过髙产率反而下降_______,该实验加热方式为____________。
(4)分析所制得的碱式碳酸铜的质量分数。
将已准确称量的0.5g试样样品放入300mL的锥形瓶中,加入5mL醋酸,适热使其溶解,再用l00mL水将其稀释。加入2.5gKI振荡混合,经过5分钟后,加入数滴淀粉溶液,用0.1mol/L的硫代硫酸钠溶液进行滴定。当_______时即达滴定的终点。
反应的原理:2Cu2++4I- =2CuI+I2,I2+2S2O32-=2I-+S4O62-
用0.lmol/L硫代硫酸钠40 mL,那么试样中铜的质量百分率为________。该溶液的滴定度为_______。(毎毫升标准溶液相当于被测物质的质量,单位是g/mL或mg/mL)(保留三位有效数字)。
-
碱式碳酸铜[xCuCO3·yCu(OH)2],呈孔雀绿颜色.又称为孔雀石,是一种名贵的矿物宝石。它与铜与空气中的氧气、二氧化碳和水蒸气等物质反应产生的物质。CuSO4溶液与Na2CO3溶液反应可以得到碱式碳酸铜,我们将对其组成进行相关探究。
[沉淀制备]
称取12. 5 g胆矾(CuSO4• 5H2O)溶于87. 5mL蒸馏水中,滴加少量稀硫酸(体积可以忽略不计),充分搅拌后得到CuSO4溶液。向其中加入Na2CO3溶液,将所得蓝绿色悬浊液过滤,并用蒸馏水洗涤,再用无水乙醇洗涤,最后低溫烘干备用。
[实验探究]我们设计了如下装置,用制得的蓝绿色固体进行实验。
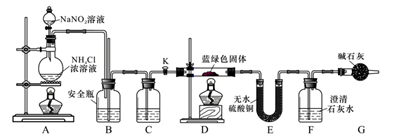
根据以上实验回答下列问题
(1)配制硫酸铜溶液的过程中滴加稀硫酸的作用是___________,所得硫酸铜溶液的溶质质量分数为_________
(2)实验室通常使用加热亚硝酸钠和氯化铵混合溶液的方法制取N2,该反应的化学方程为:__________。
⑶D装置加热前,需要首先打开活塞K,通入适量N2,然后关闭K,再点燃D处酒精灯。通入N2的作
用___________, B为安全瓶,其作用原理为_________,C中盛装的试剂应是__________。
(4)加热D后观察到的现象是________________。
(5)经查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2溶液代替澄清石灰水来定量测定蓝绿色固体的化学式,其原因是______________
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是______________。若装置F中使用Ba(OH)2溶液,实验结束后经称量,装置E的质量增加0.27 g,F中产生沉淀1.97 g。则该蓝绿色固体的化学式为_____________。[写成xCuCO3·yCu(OH)2的形式]
-
碱式碳酸铜[xCuCO3·yCu(OH)2],呈孔雀绿颜色.又称为孔雀石,是一种名贵的矿物宝石。它与铜与空气中的氧气、二氧化碳和水蒸气等物质反应产生的物质。CuSO4溶液与Na2CO3溶液反应可以得到碱式碳酸铜,我们将对其组成进行相关探究。
[沉淀制备]称取12. 5 g胆矾(CuSO4• 5H2O)溶于87. 5mL蒸馏水中,滴加少量稀硫酸(体积可以忽略不计),充分搅拌后得到CuSO4溶液。向其中加入Na2CO3溶液,将所得蓝绿色悬浊液过滤,并用蒸馏水洗涤,再用无水乙醇洗涤,最后低温烘干备用。
[实验探究]我们设计了如下装置,用制得的蓝绿色固体进行实验。
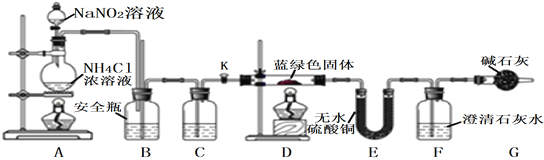
根据以上实验回答下列问题
(1)配制硫酸铜溶液的过程中滴加稀硫酸的作用是_______________________________,
所得硫酸铜溶液的溶质质量分数为_____________________。
(2)实验室通常使用加热亚硝酸钠和氯化铵混合溶液的方法制取N2,该反应的化学方程为:__________________________________________________。
(3)D装置加热前,需要首先打开活塞K,通入适量N2,然后关闭K,再点燃D处酒精灯。
C中盛装的试剂应是___________。加热D后观察到的现象是_______________________。
(4)经查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2溶液代替澄清石灰水来定量测定蓝绿色固体的化学式,其原因是(____)
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(5)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是_____________。若装置F中使用Ba(OH)2溶液,实验结束后经称量,装置E的质量增加0.27 g,F中产生沉淀1.97 g。则该蓝绿色固体的化学式为_____________。[写成xCuCO3·yCu(OH)2的形式]
-
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L–1的Cu(NO3)2溶液、2.0mL 0.50 mol·L–1的NaOH溶液和0.25 mol·L–1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
表Ⅰ 表Ⅱ
| 编号 | V (Na2CO3)/mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是________。
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是________。
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
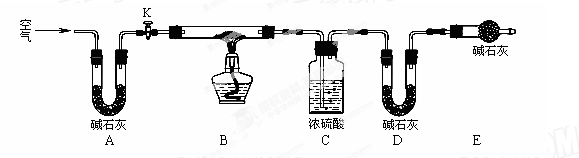
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:________(请补充该步操作内容)。
步骤5:称量相关装置的质量。
①装置A的作用是________;若无装置E,则实验测定的x/y的值将________。(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的________(写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式________。
-
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
⑴孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L—1的Cu(NO3)2溶液、2.0mL 0.50 mol·L—1的NaOH溶液和0.25 mol·L—1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
| 编号 | V (Na2CO3)/ mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |
表Ⅰ 表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是________。
②80℃时,所制得的孔雀石有少量褐色物质的原因是________。
⑵实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
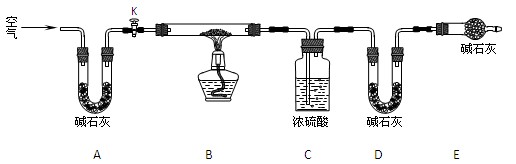
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:________。
步骤5:称量相关装置的质量。
①装置A的作用是________;若无装置E,则实验测定的x/y的值将________(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的________(写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式________。
-
孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
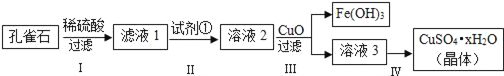
(1)步骤Ⅰ中涉及的主要反应用离子方程式表示为_____.
(2)步骤Ⅱ中试剂①是_____(填代号).
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅲ加入CuO的目的是_____.
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____、_____、过滤等操作.
(5)孔雀石与焦炭一起加热可以生成Cu及其它无毒物质,写出该反应的化学方程式_____.
(6)测定硫酸铜晶体(CuSO4•xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在____(填实验仪器名称)中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=_____(计算结果精确到0.1).
-
孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
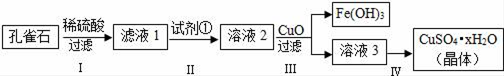
(1)步骤Ⅰ中涉及的主要反应用离子方程式表示为_____.
(2)步骤Ⅱ中试剂①是_____(填代号).
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅲ加入CuO的目的是_____.
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____、_____、过滤等操作.
(5)孔雀石与焦炭一起加热可以生成Cu及其它无毒物质,写出该反应的化学方程式_____.
(6)测定硫酸铜晶体(CuSO4•xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在____(填实验仪器名称)中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=_____(计算结果精确到0.1).
-
孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
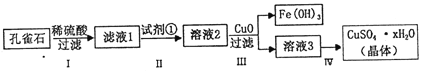
(1)步骤I中涉及的主要反应用离子方程式表示为__________.
(2)步骤Ⅱ中试剂①是_______(填代号).
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
(3)步骤Ⅲ加入CuO 的目的是_________
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____________冷却结晶、过滤等操作.
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在坩埚中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=______(计算结果精确到0.1)
-
孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备 硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的一组离子正确的是( )
A.加入过量NaClO溶液:Fe2+、H+、Cu2+、SO42-
B.加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
C.加入过量氨水:Fe3+、NH4+、SO42-、OH-
D.加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
-
孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-







