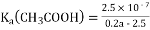-
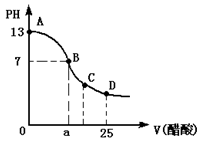
(12分)在25mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸 溶液,滴定曲线如图所示,
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式 ;
(2)该氢氧化钠溶液的物质的量浓度为________mol/L;
(3)在B点,a________12.5ml(填“大于”、“小于”或“等于”,下同)。若由体积相等的氢氧化钠和醋酸混合而且恰好呈中性,则混合前c(NaOH)________ c(CH3COOH),混合前酸中 c(H+)和碱中c(OH-)的关系:c(H+)________c(OH-);
(4)在D点溶液中离子浓度大小关系为________ 。
-
在25mL氢氧化钠溶液中逐滴加入0.2mol•L-1醋酸溶液,滴定曲线如图所示.
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式:______.
(2)该氢氧化钠溶液的物质的量浓度为______ mol•L-1.
(3)在B点,a______ 12.5mL(填“>”、“<”或“=”,下同).若由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,则混合前c(NaOH)______ c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)______c(OH-).
(4)在D点,溶液中离子浓度大小关系为:______.
-
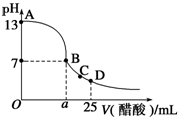
在 25mL 的氢氧化钠溶液中逐滴加入 0.2 mol/ L 醋酸溶液,滴定曲线如图所示。
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________________
(2)该氢氧化钠溶液浓度为______________
(3)在B点,a____12.5mL(填“>”“<”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合恰好中性,则混合前c(NaOH)____c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____c(OH-)(填“>”“<”或“=”)。
-
I、在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。
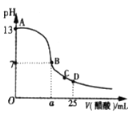
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式:_____________________。
(2)该氢氧化钠溶液浓度为________________。
(3)在B点,a_________12.5 mL(填“<”“>”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合且恰好呈中性,则混合前c(NaOH)____________c(CH3COOH),混合前酸中c(H +)和碱中的c(OH -)的关系:c(H +)____________c(OH -)(填“<”“>”或“=”)。
(4)在D点,溶液中离子浓度大小关系为_______________________________。
II、相同物质的量浓度的NaX、NaY、NaZ三种盐溶液的pH分别为7、8、9,则相同物质的量浓度的HX、HY、HZ的酸性强弱顺序为:__________________________。
III、下列电解质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH;⑤BaSO4;⑥AgCl;⑦ H2O,________________是强电解质;______________是弱电解质。
IV、有浓度为0.1 mol•L-1的盐酸、醋酸二种溶液,试回答:
(1)二种溶液中c(H+) 依次为a mol•L-1,b mol•L-1,其大小顺序为__________。
(2)等体积的以上二种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n 1mol,n2 mol,它们的大小关系为____________。
(3)与锌反应时产生氢(气)的速率刚开始一段时间分别为v1、v2,其大小关系为_______。
V、25℃时,有0.01 mol•L-1的醋酸溶液,则醋酸的电离平衡常数表达式为____________,达平衡时,溶液中氢离子浓度是____________。(提示:25℃时,醋酸的电离平衡常数为1. 85×10 -5,醋酸的电离常数很小,平衡时C(CH3COOH)=0.01 mol•L-1,4.32=18.5)
-
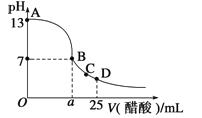
在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。

(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________________。
(2)该氢氧化钠溶液浓度为_______________。
(3)在B点,a___ _____12.5 mL(填“<”“>”或“=”)。
若由体积相等的氢氧化钠溶液和醋酸溶液混合且恰好呈中性,则混合前c(NaOH) c(CH3COOH),混合前酸中c(H +)和碱中的c(OH -)的关系:c(H +) c(OH -)(填“<”“>”或“=”)。
(4)在D点,溶液中离子浓度大小关系为______________________________________。
-
Ⅰ.25℃时在25 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示.下列说法正确的是__________________

A.滴定终点时俯视读数则测定的氢氧化钠浓度偏高
B.B、C、D三点的溶液中水的电离程度为B>C>D
C.D点,c(CH3COO-)+ c(CH3COOH)>2c(Na+)
D.B点为滴定终点
E.B点时c(CH3COO-)=c(Na+)
F. 若由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,则混合前c(NaOH)< c(CH3COOH)
G.滴定前的氢氧化钠溶液的浓度为0.1mol/L
Ⅱ.(1)为了检验某残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,写出滴定过程中反应的离子方程式:________________________________________KMnO4应装在___________滴定管中(填“酸式”或“碱式”)滴定前是否要滴加指示剂?___(填“是”或“否”),滴定终点的判断方法:_____________________________
(2)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入______________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________。[Fe(OH)3的Ksp=2.6×10-39]
-
在25.00 mL氢氧化钠溶液中逐滴加入0.2000 mol·L-1醋酸溶液,滴定曲线如图所示。
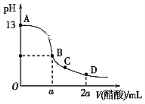
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________。
(2)该氢氧化钠溶液的物质的量浓度为_________mol·L-1。
(3)设在B点时酸碱恰好中和,则a=____________。
(4)若所加入的酸为0.2000 mol·L-1的盐酸,则D点时溶液的c(H+)=________。
-
25 ℃时,向25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是
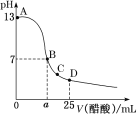
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. 用含a的代数式表示CH3COOH的电离常数K=2.5×10—7/(0.2a-2.5)
C. C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
-
25℃时,向25mL 0.1mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )
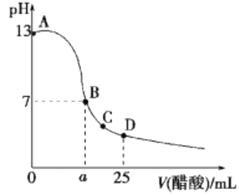
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. 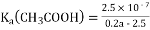
C. C点对应的溶液中,水电离出的H+浓度大于10-7mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH) =2c(H+) -c(OH-)
-
25℃时,向25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是

A.在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.Ka(CH3COOH)=
C.C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
D.D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)