-
某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下KIO3是一种较强的氧化剂。
已知:①IO3—+5I—+6H+=3I2+3H2O;②H2S2O3是弱酸。
学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取w g加碘盐,加适量蒸馏水溶解,配制成100mL溶液;
b.取25.00mL用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.20×10﹣3 mol•L﹣1的 Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32﹣═2I﹣+S4O62﹣),若平行实验三次,记录的数据如下表:
滴定次数
待测溶液的体积(/mL)
标准Na2S2O3溶液的体积
滴定前读数(/mL)
滴定后读数(/mL)
1
25.00
1.01
21.02
2
25.00
1.00
20.99
3
25.00
2.10
20.02
(1)滴定时,Na2S2O3溶液应放在_____(填“酸式”或“碱式”)滴定管;
(2)判断到达滴定终点的实验现象是_______________________________;
(3)根据题中所给数据,可知w g加碘食盐样品中的含碘元素质量是______mg;
(4)滴定前读数正确,滴定后俯视读数,则对滴定结果的影响是__ (填“偏大”或“偏小”或“无影响”)。
高二化学实验题困难题查看答案及解析
-
加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI 溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定 (滴定时的反应方程式: I2+2S2O32-=2I-+S4O62-)。
操作b 涉及的主要反应的离子方程式为_____;滴定时,Na2S2O3溶液应放在_____(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是________mg/kg (以含w的代数式表示)。
(2) 学生乙对纯净的NaCl (不含KIO3 )进行了下列实验:
顺序
步骤
实验现象
①
取少量纯净的NaCl,加蒸馏水溶解
溶液无变化
②
滴入淀粉-KI溶液,振荡
溶液无变化
③
放置片刻,再滴加稀H2SO4,振荡
溶液变蓝色
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________。由学生乙的实验结果推知,学生甲的实验结果将_______(填“偏大”、“偏小”或“无影响”)。
高二化学实验题中等难度题查看答案及解析
-
加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI 溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定 (滴定时的反应方程式: I2+2S2O32-=2I-+S4O62-)。
操作b 涉及的主要反应的离子方程式为_____;滴定时,Na2S2O3溶液应放在_____(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是________mg/kg (以含w的代数式表示)。
(2) 学生乙对纯净的NaCl (不含KIO3 )进行了下列实验:
顺序
步骤
实验现象
①
取少量纯净的NaCl,加蒸馏水溶解
溶液无变化
②
滴入淀粉-KI溶液,振荡
溶液无变化
③
放置片刻,再滴加稀H2SO4,振荡
溶液变蓝色
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________。由学生乙的实验结果推知,学生甲的实验结果将_______(填“偏大”、“偏小”或“无影响”)。
高二化学实验题中等难度题查看答案及解析
-
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.
(1)工业生产碘酸钾的流程如下:
已知步骤①反应器中发生的反应为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.其中KH(IO3)2中I元素的化合价是______.碘酸钾的溶解度见表:
操作③得到碘酸钾晶体的方法是______.温度/℃ 20 40 60 80 KIO3/100gH2O 8.08 12.6 18.3 24.8
(2)加碘食盐中碘元素的测定.
①已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-
学生甲设计的实验步骤如下:
步骤1:准确称取w g食盐,加适量蒸馏水使其完全溶解;
步骤2:用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
步骤3:以淀粉为指示剂,逐滴加入2.0×10-3 mol•L-1的Na2S2O310.0mL,恰好反应完全.则食盐样品中的碘元素含量是______mg•kg-1(以含w的代数式表示).
②学生乙另取纯净的NaCl进行了下列实验:
实验中产生蓝色现象的可能原因是______(用离子方程式表示).实验步骤 实验操作 实验现象 步骤1 取1g纯净的NaCl,加3mL水配成溶液. 溶液无变化 步骤2 滴入5滴淀粉溶液和1mL0.1 mol•L-1KI溶液,振荡. 溶液无变化 步骤3 然后再滴入1滴1 mol•L-1的H2SO4,振荡. 溶液变蓝色
③根据学生乙的实验结果,学生甲测得的食盐中碘元素的含量可能______(填“偏高”、“偏低”或“准确”).原因是______.高二化学解答题中等难度题查看答案及解析
-
加碘食盐中含碘酸钾(KIO3),化学兴趣小组对加碘食盐展开研究性学习。
(1)加碘食盐中KIO3的制备可以采用以下两种方法:
方法一:碘单质与KClO3溶液反应生成KIO3和Cl2;
方法二:碘单质与H2O2在催化剂作用下反应生成HIO3,再与K2CO3作用生成KIO3;两种方法制等质量的KIO3,理论上消耗KClO3和H2O2的物质的量之比为 _______ 。
(2)兴趣小组测定食用精制盐中碘元素含量的实验步骤为:
步骤1:准确称取25.00 g食盐,加适量蒸馏水使其完全溶解,配成100.00 mL溶液;
步骤2:取所配溶液25.00 mL于锥形瓶中,用稀硫酸酸化该溶液,加入足量KI溶液,使之充分反应;
步骤3:滴入2~3滴淀粉溶液作指示剂,用1.0×10-3 mol·L-1的Na2S2O3标准溶液滴定至终点,恰好完全反应时消耗12.00 mL标准溶液。
已知步骤3中所发生反应的离子方程式为I2+2S2O32-=2I-+S4O62-。
①步骤3中滴定终点的现象是 _______ 。
②下列情况会使测定结果偏大的是 _______ 。
A 装Na2S2O3标准溶液的滴定管水洗后未用Na2S2O3标准溶液润洗
B 装Na2S2O3标准溶液的滴定管滴定前有气泡,滴定终了无气泡
C 滴定时未充分振荡,溶液局部变色就终止
D 若其他读数正确,滴定结束读数时俯视
③计算该精制盐的碘元素含量(mg·kg-1),写出计算过程_______。
高二化学实验题中等难度题查看答案及解析
-
氯化亚铜(CuCl)是白色粉末,微溶于水,能与稀硫酸反应,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuC12•2H2O制备CuCl,并进行相关探究(已知酸性条件下Cu+不稳定)。
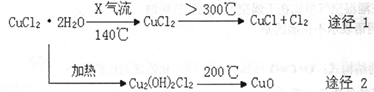
下列说法正确的是
A. X气体可以是N2,目的是做保护气,抑制CuCl2•2H2O加热过程可能的水解
B. CuCl与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
C. 途径1中产生的Cl2可以回收循环利用,也可以通入饱和CaCl2溶液中除去
D. 途径2中200℃下反应的化学方程式为:Cu2(OH)2Cl2
2CuO + 2HCl
高二化学选择题中等难度题查看答案及解析
-
加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应.
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为______;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液.总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极______,阳极______.高二化学解答题中等难度题查看答案及解析
-
加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为 ;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极 ,阳极 。
高二化学填空题中等难度题查看答案及解析
-
(4分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为________;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极________,阳极________
高二化学填空题简单题查看答案及解析
-
近年来,加“碘”食盐中添加较多的是碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极材料,以KI溶液为电解液,在一定条件下进行电解,反应的化学方程式为KI+3H2O
KIO3+3H2↑。下列有关说法不正确的是
A. 加碘食盐不能使淀粉溶液变蓝
B. 电解时,石墨作阳极,不锈钢作阴极
C. 阳极的电极反应式为I-+3H2O+6e-=IO3-+6H+
D. 转移3 mol电子,理论上可制得107 g KIO3
高二化学单选题中等难度题查看答案及解析