-
加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI 溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定 (滴定时的反应方程式: I2+2S2O32-=2I-+S4O62-)。
操作b 涉及的主要反应的离子方程式为_____;滴定时,Na2S2O3溶液应放在_____(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是________mg/kg (以含w的代数式表示)。
(2) 学生乙对纯净的NaCl (不含KIO3 )进行了下列实验:
顺序
步骤
实验现象
①
取少量纯净的NaCl,加蒸馏水溶解
溶液无变化
②
滴入淀粉-KI溶液,振荡
溶液无变化
③
放置片刻,再滴加稀H2SO4,振荡
溶液变蓝色
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________。由学生乙的实验结果推知,学生甲的实验结果将_______(填“偏大”、“偏小”或“无影响”)。
高二化学实验题中等难度题查看答案及解析
-
加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI 溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定 (滴定时的反应方程式: I2+2S2O32-=2I-+S4O62-)。
操作b 涉及的主要反应的离子方程式为_____;滴定时,Na2S2O3溶液应放在_____(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是________mg/kg (以含w的代数式表示)。
(2) 学生乙对纯净的NaCl (不含KIO3 )进行了下列实验:
顺序
步骤
实验现象
①
取少量纯净的NaCl,加蒸馏水溶解
溶液无变化
②
滴入淀粉-KI溶液,振荡
溶液无变化
③
放置片刻,再滴加稀H2SO4,振荡
溶液变蓝色
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________。由学生乙的实验结果推知,学生甲的实验结果将_______(填“偏大”、“偏小”或“无影响”)。
高二化学实验题中等难度题查看答案及解析
-
某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下KIO3是一种较强的氧化剂。
已知:①IO3—+5I—+6H+=3I2+3H2O;②H2S2O3是弱酸。
学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取w g加碘盐,加适量蒸馏水溶解,配制成100mL溶液;
b.取25.00mL用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.20×10﹣3 mol•L﹣1的 Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32﹣═2I﹣+S4O62﹣),若平行实验三次,记录的数据如下表:
滴定次数
待测溶液的体积(/mL)
标准Na2S2O3溶液的体积
滴定前读数(/mL)
滴定后读数(/mL)
1
25.00
1.01
21.02
2
25.00
1.00
20.99
3
25.00
2.10
20.02
(1)滴定时,Na2S2O3溶液应放在_____(填“酸式”或“碱式”)滴定管;
(2)判断到达滴定终点的实验现象是_______________________________;
(3)根据题中所给数据,可知w g加碘食盐样品中的含碘元素质量是______mg;
(4)滴定前读数正确,滴定后俯视读数,则对滴定结果的影响是__ (填“偏大”或“偏小”或“无影响”)。
高二化学实验题困难题查看答案及解析
-
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.
(1)工业生产碘酸钾的流程如下:
已知步骤①反应器中发生的反应为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.其中KH(IO3)2中I元素的化合价是______.碘酸钾的溶解度见表:
操作③得到碘酸钾晶体的方法是______.温度/℃ 20 40 60 80 KIO3/100gH2O 8.08 12.6 18.3 24.8
(2)加碘食盐中碘元素的测定.
①已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-
学生甲设计的实验步骤如下:
步骤1:准确称取w g食盐,加适量蒸馏水使其完全溶解;
步骤2:用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
步骤3:以淀粉为指示剂,逐滴加入2.0×10-3 mol•L-1的Na2S2O310.0mL,恰好反应完全.则食盐样品中的碘元素含量是______mg•kg-1(以含w的代数式表示).
②学生乙另取纯净的NaCl进行了下列实验:
实验中产生蓝色现象的可能原因是______(用离子方程式表示).实验步骤 实验操作 实验现象 步骤1 取1g纯净的NaCl,加3mL水配成溶液. 溶液无变化 步骤2 滴入5滴淀粉溶液和1mL0.1 mol•L-1KI溶液,振荡. 溶液无变化 步骤3 然后再滴入1滴1 mol•L-1的H2SO4,振荡. 溶液变蓝色
③根据学生乙的实验结果,学生甲测得的食盐中碘元素的含量可能______(填“偏高”、“偏低”或“准确”).原因是______.高二化学解答题中等难度题查看答案及解析
-
加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应.
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为______;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液.总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极______,阳极______.高二化学解答题中等难度题查看答案及解析
-
加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为 ;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极 ,阳极 。
高二化学填空题中等难度题查看答案及解析
-
(4分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为________;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极________,阳极________
高二化学填空题简单题查看答案及解析
-
(1)化学与生活密切相关,下列说法不正确的是 _________
A. 抗酸药能中和胃里过多的盐酸,缓解胃部不适
B. 柠檬因为有酸味,所以属于酸性食品
C. 目前加碘食盐中碘元素以KIO3形式存在
D. 利用油脂在碱性条件下的水解,可以制甘油和肥皂
(2)化学与生活息息相关。下列叙述正确的是 _________
A. 土豆的淀粉经水解可变成酒 B. 油脂经水解可变成葡萄糖
C. 鲜榨橙汁遇到碘水会变蓝 D. 馒头越嚼越甜
(3)纤维素被称为“第七营养素”。食物中的纤维素虽然不能被消化,但能刺激肠道蠕动和分泌消化液,有助于食物的消化和废物的排泄。在化学分类中,纤维素属于_________
A.蛋白质 B.脂肪 C.多糖
(4)某种食品的配料标签如图所示:

①其中,富含蛋白质的物质是______,富含油脂的物质是______,有防腐作用的是______。
②用于包装该食品的聚乙烯塑料包装属于______(填字母)。
A.有机高分子材料 B.无机非金属材料 C.金属材料
③大量使用塑料包装,会造成“____污染”,这种包装袋属于______(可回收资源 / 不可回收资源)。
高二化学简答题中等难度题查看答案及解析
-
氯化亚铜(CuCl)是白色粉末,微溶于水,能与稀硫酸反应,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuC12•2H2O制备CuCl,并进行相关探究(已知酸性条件下Cu+不稳定)。
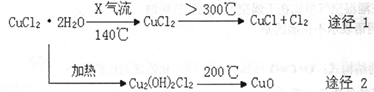
下列说法正确的是
A. X气体可以是N2,目的是做保护气,抑制CuCl2•2H2O加热过程可能的水解
B. CuCl与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
C. 途径1中产生的Cl2可以回收循环利用,也可以通入饱和CaCl2溶液中除去
D. 途径2中200℃下反应的化学方程式为:Cu2(OH)2Cl2
2CuO + 2HCl
高二化学选择题中等难度题查看答案及解析
-
下列说法正确的是
A、在酒精灯加热条件下,碳酸钠,碳酸氢钠固体都能发生分解
B、灼烧白色粉末火焰成黄色,证明有Na +无K+
C、铝罐可以久盛食醋
D、可以用钠鉴别乙醇和乙醚
高二化学选择题中等难度题查看答案及解析