-
CO2和CH4均为温室气体,若得以综合利用,对温室气体整治具有重大意义。
(1)已知:
CO2(g)+CH4(g) 2CO(g)+2H2(g) △H=+247.3kJ·mol-1
2CO(g)+2H2(g) △H=+247.3kJ·mol-1
CH4(g) C(s)+2H2(g) △H=+75.0kJ·mol-1
C(s)+2H2(g) △H=+75.0kJ·mol-1
反应2CO(g) C(s)+CO2(g)在_______能自发进行。
C(s)+CO2(g)在_______能自发进行。
A、高温 B、低温 C、任意温度 D、任意温度都不能
(2)合成甲醇的主要反应是CO(g)+2H2(g) CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
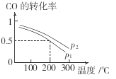
①下列判断正确的是______
A、放热反应 P1>P2 B、放热反应 P1<P2
C、吸热反应 P1>P2 D、吸热反应 P1<P2
②200℃时,该反应的平衡常数K=_______(用含b的代数式表示)。若上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为_______。
(3)实验室可用Na2CO3 与盐酸混合制备少量CO2。在25℃时,取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示。则:
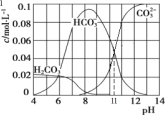
①根据图中数据,计算CO32-的水解常数K=____________________。
②pH = 6的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)_____(填>、<或=)0.1 mol·L-1
(4)以甲烷为燃料的酸性燃料电池负极反应式:___________________________
-
天然气是一种清洁的化石燃料,也是引起温室效应的一种物质。天然气的综合利用对节能减排、高效利用能源、减少二氧化碳排放有重大意义。作为化工原料,合成甲醇是天然气综合利用的重要途径。
CH4(g)+ CO2(g) 2CO(g)+ 2H2(g)△H=+247.3 kJ·mol—1 ①
2CO(g)+ 2H2(g)△H=+247.3 kJ·mol—1 ①
CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.2 kJ·mol—1 ②
CO(g)+3H2(g) △H=+206.2 kJ·mol—1 ②
Ⅰ、合成甲醇的主要反应为:2H2(g)+ CO(g) CH3OH(g) △H=-90.8 kJ·mol—1
CH3OH(g) △H=-90.8 kJ·mol—1
(1)该反应熵变△S________0(填“>、=或<”),该反应在______(填“高温”或“低温”)条件下能自发进行。
(2)生产过程中,合成气要循环,其目的是:________________________________。
(3)T℃下此反应的平衡常数为160。某时刻测得各组分的浓度如下,比较此时正、逆反应速率的大小:υ(正)________υ(逆)(填“>”“<”或“=”)
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L—1) | 0.20 | 0.10 | 0.40 |
(4)在恒温恒容条件下,充入一定量的H2和CO,发生上述反应,则该反应达到平衡状态的标志有(__________________)
A.混合气体的密度保持不变 B.混合气体的总压强保持不变
C.甲醇的浓度保持不变 D.υ正(H2)= υ逆(CH3OH)
(5)在恒温恒容条件下,要提高反应2H2(g)+ CO(g) CH3OH(g)中CO的转化率,可以采取的措施是(______________)
CH3OH(g)中CO的转化率,可以采取的措施是(______________)
A.升温 B.加入催化剂 C.增加CO的浓度
D.增加H2的浓度 E.充入惰性气体 F.分离出甲醇
Ⅱ、合成甲醇的另一反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0)。
CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0)。
在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生上述反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
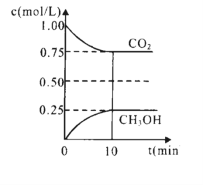
(6)下列措施中能使n(CH3OH )/n(CO2 )增大的是______(填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
(7)经计算该温度下此反应的平衡常数K=0.20 L2·mol—2。若改变条件_________(填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
(8)10min内,用H2表示的该反应的化学反应速率为=_________mol·L—1·min—1
-
CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH==______ kJ·mol−1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) |
| ΔH/(kJ·mol−1) | 75 | 172 |
| 活化能/ (kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
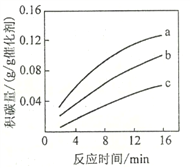
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
-
CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH==______ kJ·mol−1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) |
| ΔH/(kJ·mol−1) | 75 | 172 |
| 活化能/ (kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。
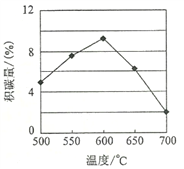
A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
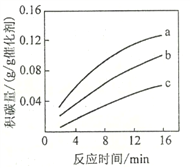
-
“低碳经济”已成为全世界科学家研究的重要课题,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L-2。
(2)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3−)∶c(CO32 -)=2∶1,溶液pH=____。(室温下,H2CO3的K1=4×10-7;K2=5×10-11),0.1mol·L-1 NaHCO3溶液中阴离子的浓度由大到小的顺序为______________
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______极,该电极反应式是___________________________________
-
“低碳经济”已成为全世界科学家研究的重要课题,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L-2。
(2)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3−)∶c(CO32 -)=2∶1,溶液pH=____。(室温下,H2CO3的K1=4×10-7;K2=5×10-11),0.1mol·L-1 NaHCO3溶液中阴离子的浓度由大到小的顺序为______________
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______极,该电极反应式是___________________________________
-
CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
(2)CO2可以被NaOH溶液捕获。
①若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3−)∶c(CO32−)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×10−7;K2=5×10−11)
②当2molCO2通入3molNaOH被吸收时,溶液中离子浓度关系正确的是(选填字母)________。
a.c(Na+)+c(H+)=c(CO32−)+c(HCO3-)+c(OH-)
b.c(Na+)>c(HCO3-)>c(CO32−)> c(OH-)>c(H+)
c.3c(Na+)=2[c(CO32−)+c(HCO3-) +c(H2CO3)]
(3)CO2辅助的CO—O2燃料电池,工作原理如图所示,固体介质中CO32— 可定向移动。电池的负极反应式:________________________________电池工作时需向某电极通入CO2以触发反应,该电极为_____________(填“甲”或“乙”)
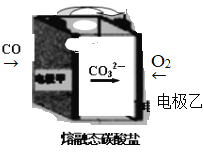
-
CO2是一种廉价的碳资源,CO2及碳的其他化合物综合利用具有重要意义
回答下列问题:
(1)CO2与CH4经催化重整制得合成气:CH4(g)+C02(g)  2CO(g)+2H2(g)ΔH=+120kJ·mol-1有利于提高CH4平衡转化率的条件是_______(填标号)
2CO(g)+2H2(g)ΔH=+120kJ·mol-1有利于提高CH4平衡转化率的条件是_______(填标号)
A高温低压 B.低温高压 C.高温高压 D.低温低压
(2)以甲烷为燃料的新型燃料电池,目前已得到了广泛的研究,如图是甲烷燃料电池原理示意图,回答下列问题:

电池的负极是_______(填“a”或“b”)电极,该极的电极反应式为____________________________
(3)CO2可以被NaOH溶液捕获,若所得溶液c(HCO3-):c(CO32-)=2:1,溶液pH=__________(室温下,H2CO3的K1=4×10-7,,K2=5×10-11) 0.1mol/L NaHCO3溶液中阴离子的浓度由大到小的顺序为_____________________________________
(4)已知25oC,H2SO3的Ka1=1.3×10-2Ka2=6.2×10-8,将SO2通入氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中 的c(SO32-)/c(HSO3-)=________________
-
研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____________________。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____________________。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
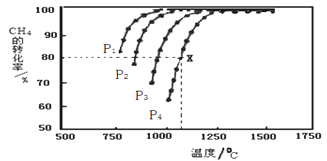
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因_________________________。
②在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为_____,该温度下,反应的平衡常数为_____________________(保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是____________________。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.气体平均相对分子质量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向___________(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为_____________________。
-
研究CO2与CH4反应使之转化为CO 和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知该转化反应为CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH,为加快该反应的化学反应速率,应采用的有效措施有________________________________________________(填写两种)。
2CO(g)+2H2(g) ΔH,为加快该反应的化学反应速率,应采用的有效措施有________________________________________________(填写两种)。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH,测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g) ΔH,测得CH4的平衡转化率与温度、压强的关系如下图所示。

①由图可知,该反应的ΔH____________0 (填写“大于”或者“小于”),P1、P2、P3、P4由大到小的顺序为_________________________。
②工业生产时一般会选用P4和1250℃进行合成,请解释其原因______________________________。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为_________________mol·L-1·min-1。
④1100℃的条件下,反应的平衡常数K的表达式为K=______________________,经计算K的数值为K=_____________(保留3位有效数字),若要使K减小可采取的措施是_________________。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
① 在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是_______________
A. H2、CO和H2O的物质的量之比为1:1:1 B.体系压强不再变化
C. 气体平均相对分子质量不变 D.混合气体的密度保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2mol H2(g)和一定量的C(s),如果此时对体系加压,平衡向_______(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为________________。
2CO(g)+2H2(g) △H=+247.3kJ·mol-1
C(s)+2H2(g) △H=+75.0kJ·mol-1
C(s)+CO2(g)在_______能自发进行。
CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:










