-
钼(Mo)及其合金在冶金、农业、电气、化工、环保和宇航等重要领域有着广泛的应用和良好的前景,成为国民经济中一种重要的原料和不可替代的战略物质。钼酸钠晶体(Na2MoO4 ·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分 MoS2 )制备钼酸钠晶体和金属钼的流程如图所示:
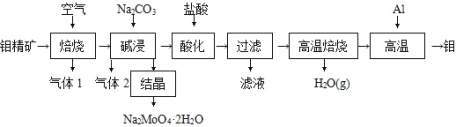
请回答下列问题:
(1)Na2 MoO 4·2H2O 中 Mo 的化合价是 ________。
(2)已知“焙烧”过程中 MoS2 变成 MoO3,则气体 1 中对大气有污染的是 ________。
(3)“碱浸”过程中生成 Na2MoO4 的化学方程式是 ________;“结晶”的钼酸钠晶体仍含其他杂质,要得到较纯的晶体,还应采取的方法是 ________。
(4)“滤液”的主要成分是 ________。
(5)将过滤操作得到的钼酸沉淀进行高温焙烧,实验室模拟高温焙烧时用于盛放钼酸的仪器是 ________。
(6)钼酸高温焙烧的产物与 Al 在高温下发生反应的化学方程式是 ________。
(7)测得碱浸液中部分离子浓度为:c(MoO42-) =0.4 mol·L-1,c(SO42-) =0.02 mol·L-1。结晶前加入氢氧化钡固体除去SO42-,不考虑加入氢氧化钡固体后溶液体积的变化,当BaMoO4开始沉淀时,SO42- 的去除率为 ________ (保留三位有效数字)。 [已知: Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
-
钼(Mo) 是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:____Mo+____HF +____HNO3=____ MoO2F2+____ MoOF4+____NO2↑+____ _________
(2)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =_________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(3)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
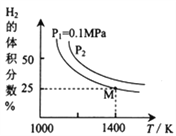
①由图可知,该反应的ΔH__0(填“>”或“<”) ;P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为____ (计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
-
钼(Mo) 是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:____Mo+____HF +____HNO3=____ MoO2F2+____ MoOF4+____NO2↑+____ _________
(2)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =_________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(3)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
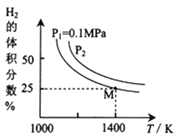
①由图可知,该反应的ΔH__0(填“>”或“<”) ;P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为____ (计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
-
钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4 和MoO2F2物质的量比为1:1,完成下列方程式:
____Mo+____HF+_____HNO3=_______MoO2F2+_______MoOF4+NO2↑+_____________,___________
(2) 己知:
①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)==Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3
则ΔH3=_______(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2molMoS2参加反应,则转移电子_____mol。
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原钼矿(MoS2) 原理是:MoS2(s)+4H2(g)+2Na2CO3(s)==Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH
实验测得平衡时的有关变化曲线如图所示
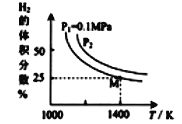
①由图可知,该反应的ΔH____0 (填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是_____(选填编号)。
A.V正(H2)=V逆(H2O)
B 再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为_____(计算结果保留0.1%) 。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数KP=_____(MPa)2
-
钼 是一种难熔稀有金属,我国的钼居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
是一种难熔稀有金属,我国的钼居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)已知:

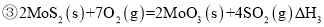 ,则
,则 ______
______ 用含
用含 、
、 的代数式表示
的代数式表示
(2)密闭容器中用 作固硫剂,同时用一定量的氢气还原辉钼矿
作固硫剂,同时用一定量的氢气还原辉钼矿 的原理是:
的原理是: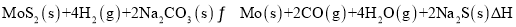 ,实验测得平衡时的有关变化曲线如图所示:
,实验测得平衡时的有关变化曲线如图所示:
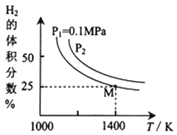
 由图可知,该反应的
由图可知,该反应的 ______0
______0  填“
填“ ”或“
”或“ ”
” ,
, ______
______ MPa
MPa  填“
填“ ”或“
”或“ ”
” 。
。
 如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______
如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______ 选填编号
选填编号 。
。
A.
 容器内气体的密度不变时,一定达平衡状态
容器内气体的密度不变时,一定达平衡状态
C.再加入 ,则
,则 转化率增大
转化率增大  容器内压强不变时,一定达平衡状态
容器内压强不变时,一定达平衡状态
(3)电氧化法提纯钼的原理:将辉钼矿 放入装有食盐水的电解槽中,用惰性电极电解,
放入装有食盐水的电解槽中,用惰性电极电解, 被氧化为
被氧化为 和
和 阴极的电极反应式为______。
阴极的电极反应式为______。
-
钼(Mo)是一种难熔稀有金属,我国的钼储量居世界前列,钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化生成X和Y(少量),X和Y中Mo价态相同,硝酸本身被还原为NO2,该反应中氧化剂与还原剂的物质的量之比为6:1,则Mo在氧化产物中的化合价为___________;
(2)已知:2Mo(s)+3O2(g)===2MoO3(s) △H1;
MoS2(s)+2O2(g)===Mo(s)+2SO2(g) △H2。
写出MoS2(s)与氧气反应生成MoO3(s)的热化学方程式_____________________________;
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为
MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
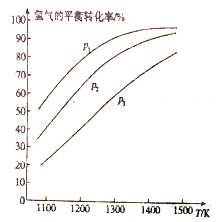
(a)不同压强下温度与H2平衡转化率的关系
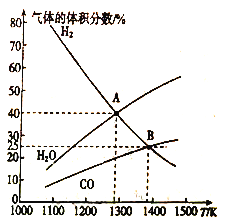
(b)0.1MPa下温度与平衡时气体成分的关系
①由图(a)可知,该反应△H___________0(填“>”或“<”),p1、p2、p3由大到小的顺序为___________;
②由图(b)可知,B点时H2的平衡转化率为___________;
③A点对应的平衡常数K=___________(MPa)2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-。
①辉钼矿应放入电解槽的___________(填“阴极区”或“阳极区”);
②阴极的电极反应式为_________________________________。
-
钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化为MoO2F2和MoOF4(少量),硝酸本身被还原为NO2,则该反应中氧化剂与还原剂的物质的量之比为_________。
(2)已知:2Mo(s)+3O2(g)=2MoO3(s) △H1;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H2;
MoS2(s)+2 O2(g)=Mo(s)+2SO2(g) △H3
则△H3=_________(用含△H1、△H2的代数式表示)
(3)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-
①辉钼矿应放入电解槽的_________(填“阴极区”或“阳极区”)。
②阴极的电极反应式为___________________________。
(4)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s)  Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
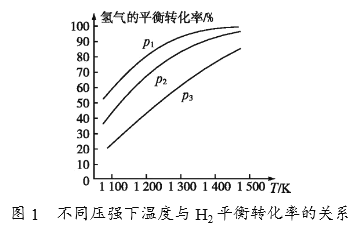
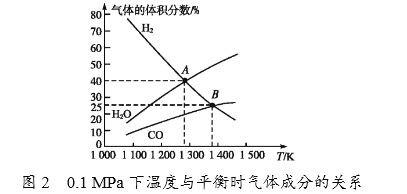
①由图1可知,该反应△H______(填“>”或“<”)0,p1、p2、p3由大到小的顺序为_______________________。
②由图2可知,A点时H2的平衡转化率为____________。
③B点对应的平衡常数K=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(MPa)2。
-
钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化为MoO2F2和MoOF4(少量),硝酸本身被还原为NO2,则该反应中氧化剂与还原剂的物质的量之比为_________
(2)已知:2Mo(s)+3O2(g)==2MoO3(s)△H1 ;
2MoS2(s)+ 7O2(g)= 2MoO3(s)+4SO2(g)△H2 ;
MoS2(s)+2O2(g)=Mo(s)+2SO2 (g)△H3
则△H3=_______(用含△Hl、△H2的代数式表示)。
(3)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-。
① 辉钼矿应放入电解槽的__________(填“阴极区”或“阳极区”)。
② 阴极的电极反应式为______________。
(4)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoOS2(s)+4H2(g) +2Na2CO3(s) MO(s)+2CO(g)+4H2O(g)+2Na2S(s)△H,实验测得平衡时的有关变化曲线如图所示。
MO(s)+2CO(g)+4H2O(g)+2Na2S(s)△H,实验测得平衡时的有关变化曲线如图所示。
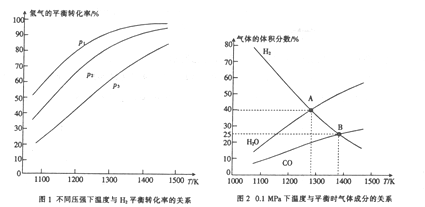
① 由图l可知,该反应△H___(填“>”或“<”)0,p1、p2、p3由大到小的顺序为____。
② 由图2可知,A点时H2的平衡转化率为____。
③ B点对应的平衡常数K=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(MPa)2 。
-
钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(l)钼酸钠晶体(Na2MoO4·2H20)可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。Na2MoO4中Mo的化合价为____。在碱性条件下,将钼精矿(主要成分为MoS2)加入NaClO溶液中,也可以制备钼酸钠,该反应的离子方程式为________。
(2)已知:
①2Mo(s)+3O2(g)=2MoO3(s)△H1
②2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)△H2
③MoS2(s)+2O2(g)=Mo(s)+2SO2(g)△H3
则△H3=_________(用含△H1、△H2的代数式表示)。
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为:MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。

图1:温度与平衡时气体成分的关系 图2:正、逆反应的平衡常数(K)与温度(T)的关系
①一定温度下,在体积为固定的密闭容器中进行上述反应,下列能说明反应达到了平衡状态的是____(填序号)。
A.2v正(H2)=v逆(CO)
B.CO体积分数保持不变
C.混合气体的平均相对分子质量不再变化
D.△H不再变化
②图1中A点对应的平衡常数Kp=__(已知A点压强为0.lMPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③综合上述分析得到:图2中,其中表示逆反应的平衡常数(K逆)的曲线是____(填“A”或“B”),T1对应的平衡常数为____。
-
钛金属重量轻、强度高、有良好的抗腐蚀能力,其单质及其化合物在航空航天、武器装备、能源、化工、冶金、建筑和交通等领域应用前景广阔。回答下列问题:
(1)三氟化钛可用于制取钛氟玻璃,基态 F 原子核外有_____个未成对电子,Ti 原子形成Ti3+时价层电子层排布式为_____。
(2)TiO2 的熔点为 1800℃,TiCl4 的熔点为-25℃,则 TiO2 的晶体类型为_____,TiCl4 熔点低的原因为_____。
(3)钛某配合物可用于催化环烯烃聚合,其结如图所示:
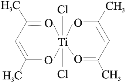
①钛的配位数为_____,该化合物中电负性最大元素是_____(填元素符号)。
②该配合物中不含有的化学键有_____(填字母标号)。
a.离子键 b.σ键 c.金属键 d.π键
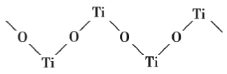
(4)已知 TiO2 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为_____,阳离子中 O 的杂化方式为_____,阴离子的空间构型为_____。
(5)氮化钛可以用于制作电池的材料,其晶胞如图,该晶胞的密度为ρ g·cm-3,与氮原子最近的且距离相等的钛原子有_____个,氮原子与钛原子最近的距离为_____cm。





 ,则
,则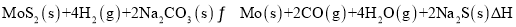 ,实验测得平衡时的有关变化曲线如图所示:
,实验测得平衡时的有关变化曲线如图所示:








