-
已知25 ℃时,HCN的电离常数Ka=6.2×10-10 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1。请根据以下四个图像回答问题。
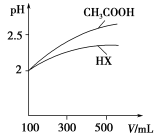
(1)25 ℃时,体积均为100 mL、pH=2的CH3COOH溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示CH3COOH溶液的pH变化趋势的曲线是:______(填“A”或“B”);相同条件下,NaCN溶液的pH________(填 “>”“=”或“<”)CH3COONa溶液的pH。将0.2 mol·L-1HCN溶液与0.1mol·L-1NaOH溶液等体积混合,若所得溶液的c(HCN)>c(Na+),则溶液中离子浓度由大到小顺序为___________________________________。

(2)如图所示,25 ℃时向20 mL 0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是_______

A.a点溶液中c(H+)为1×10-4 mol·L-1
B.a、b、c、d四点中水的电离程度最大的是c点
C.滴定过程中宜选用酚酞做指示剂
D.b点溶液中离子浓度大小顺序一定为c(CH3COO-)>c(H+)>c(K+)>c(OH-)
(3)如图表示用相同的NaOH溶液分别滴定浓度相同的三种一元酸,由图可知酸性最强的是_____(填“①”“②””或“③”)。

(4)如图表示相同浓度的AgNO3标准溶液分别滴定浓度相同的含Cl-、Br- 及I- 的混合溶液,由图可确定首先沉淀的离子是________。已知25 ℃时Ksp(AgCl)=2×10-10,在1L 0.1mol/L的NaCl溶液中加入1L 0.2mol/L的AgNO3溶液,充分反应后溶液中c(Cl-)=_________(假设混合溶液的体积为2L)

-
已知25 ℃时,HCN的电离常数Ka=6.2×10-10 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1。请根据以下四个图像回答问题。

(1)25 ℃时,体积均为100 mL、pH=2的CH3COOH溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图1所示,则表示CH3COOH溶液的pH变化趋势的曲线是:______(填“A”或“B”);相同条件下,NaCN溶液的pH________(填 “>”“=”或“<”)CH3COONa溶液的pH。将0.2 mol·L-1HCN溶液与0.1mol·L-1NaOH溶液等体积混合,则溶液中离子浓度由大到小顺序为______________。(提示:可根据平衡常数大小关系判断反应程度大小)
(2)如图2所示,25 ℃时向20 mL 0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是_______
A.a点溶液中c(H+)为1×10-4 mol·L-1
B.a、b、c、d四点中水的电离程度最大的是c点
C.滴定过程中宜选用酚酞做指示剂
D.b点溶液中离子浓度大小顺序一定为c(CH3COO-)> c(H+)>c(K+)>c(OH-)
(3)如图3表示用相同的NaOH溶液分别滴定浓度相同的三种一元酸,由图可知酸性最强的是_____(填“①”“②””或“③” )。
(4)如图4表示相同浓度的AgNO3标准溶液分别滴定浓度相同的含Cl-、Br- 及I-的混合溶液,由图可确定首先沉淀的离子是________。已知25 ℃时Ksp(AgCl)=2×10-10,在1L 0.1mol/L的NaCl溶液中加入1L 0.2mol/L的AgNO3溶液,充分反应后溶液中c(Cl-)=_________(假设混合溶液的体积为2L)
-
已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① | HF | Ka=6.8×10-4mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5mol•L-1 |
| ③ | HCN | Ka=6.2×10-10mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是______,四种酸中酸性最弱的是______.
(2)写出H2CO3电离方程式是______、______.
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:______.
-
下表是常温下某些一元弱酸的电离常数:
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.2×10-10 | 6.8×10-4 | 1.7×10-5 | 6.4×10-6 |
则0.1 mol·L-1的下列溶液中,pH最小的是
A.HCN B.HF C.CH3COOH D.HNO2
-
下表是常温下某些一元弱酸的电离常数:
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.2×10-10 | 6.8×10-4 | 1.7×10-5 | 6.4×10-6 |
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A. HCN B. HF C. CH3COOH D. HNO2
-
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)等物质的量浓度的 A.CH3COONa、B.NaCN、C.Na2CO3、D.NaHCO3溶液的pH由大到小的顺序为____________(填字母)。
(2)常温下, 0.1 mol·L-1的CH3COOH 溶液加水稀释,下列表达式的数据变大的是______。
A.C(H+) B.C(H+)/C(CH3COOH) C.C(H+)·C(OH-)
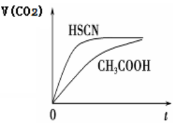
(3)25 ℃时,将 20 mL 0.1 mol·L-1 CH3COOH 溶液和 20mL0.1 mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是____________; 反应结束后所得两溶液中,(CH3COO-)________c(SCN-)(填“>”、 “<”或“=”)
(4)25 ℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,则溶液中c(CH3COO-)-c(Na+)=__________mol·L-1(填精确值), c(CH3COO-)/c(CH3COOH)=_________。
(5)用离子方程式表示Na2CO3溶液呈碱性的原因_____________________________。
-
(18分)已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为___ _____(填字母)。
(3)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号)
A.[H+] B.[H+]/[CH3COOH] C.[H+]·[OH-] D.[OH-]/[H+]
(4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L -1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
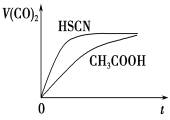
(5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(6)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值),
c(CH3COO-)/c(CH3COOH)=________。
(7)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。
-
已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
【答案】 CO32-+H2O⇌ HCO3-+OH- C>B>D>A c(Na+)>c(CN-)>c(OH-)>c(H+) B = <
【解析】(1). Na2CO3是强碱弱酸盐,碳酸根离子发生水【解析】
CO32-+H2O⇌ HCO3-+OH-,使溶液呈碱性,故答案为:CO32-+H2O⇌ HCO3-+OH-;
(2).由表中数据可知,酸性强弱顺序为:CH3COOH> H2CO3> HCN>HCO3-,根据越弱越水解的规律可知,离子的水解程度:CO32->CN->HCO3->CH3COO-,则等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3四种溶液的pH由大到小的顺序为:C>B>D>A,故答案为:C>B>D>A;
(3).在25℃时,将HCN溶液与NaOH溶液等体积等浓度混合后,二者恰好完全反应,得到NaCN溶液,因Na+不水解而CN-水解,所以c(Na+)>c(CN-),CN-水解使溶液呈碱性,则c(OH-)>c(H+),因盐的水解反应是微弱的,则c(CN-)>c(OH-),所以此溶液中离子浓度由大到小的顺序是:c(Na+)>c(CN-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);
(4).A.常温下,0.1 mol·L-1的CH3COOH 溶液加水稀释,促进醋酸的电离,使醋酸电离平衡正向移动,n(H+)增大,但c(H+)和c(CH3COO-)减小,故A错误;B. 根据Ka= 可知,
可知,  =
=  ,根据A项分析可知,c(CH3COO-)减小,因温度不变,则Ka不变,故
,根据A项分析可知,c(CH3COO-)减小,因温度不变,则Ka不变,故 =
=  增大,故B正确;C. c(H+)·c(OH-)= Kw,因温度不变,则Kw不变,故c(H+)·c(OH-)也不变,故C错误;答案选B;
增大,故B正确;C. c(H+)·c(OH-)= Kw,因温度不变,则Kw不变,故c(H+)·c(OH-)也不变,故C错误;答案选B;
(5).pH相同的不同醋酸和盐酸中,氢离子浓度相同,反应刚开始时,与Zn反应速率的相同;因醋酸是弱酸,醋酸中酸的浓度大于氢离子浓度,盐酸中酸的浓度等于氢离子浓度,所以醋酸的浓度大于HCl的浓度,则所得氢气的质量:m(H2)盐酸<m(H2)醋酸,故答案为:=;<。
点睛:本题主要考查弱电解质的电离平衡和溶液中微粒浓度的大小比较,题目难度不大。本题的易错点是第(4)小问,分析时既要结合平衡移动原理,也要善于利用平衡常数只与温度有关进行判断,如比较c(H+)/c(CH3COOH)时,可以根据Ka= 得出:
得出:  =
=  ,再根据c(CH3COO-)减小,因温度不变,则Ka不变,故
,再根据c(CH3COO-)减小,因温度不变,则Ka不变,故 =
=  增大,可以快速解决此类问题。
增大,可以快速解决此类问题。
【题型】综合题
【结束】
25
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。
Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________(中和热数值为57.3kJ/mol)。
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是__________________________。
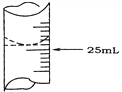
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为___________。
乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL |
| 滴定前刻度 | 滴定后刻度 |
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 33.30 |
| 3 | 25.00 | 0.22 | 26.31 |
(3)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定
D.滴定前俯视滴定管读数,滴定后平视滴定管读数
(5)滴定达到终点的标志是_________________________________________________。
-
已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
-
已知某温度下,几种酸的电离常数如下:Ka(HCN)= 6.2×10-10 mol·L-1、Ka(HF)= 6.8×10-4 mol·L-1、Ka(CH3COOH)= 1.8×10-5 mol·L-1、、Ka(HNO2)= 6.4×10-6mol·L-1。则物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A.NaCN B.NaF C.CH3COONa D.NaNO2








