-
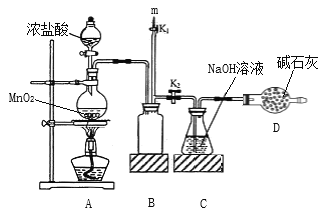
次氯酸钠是家用消毒剂的有效成分。实验室制备次氯酸钠的装置如下图甲所示。
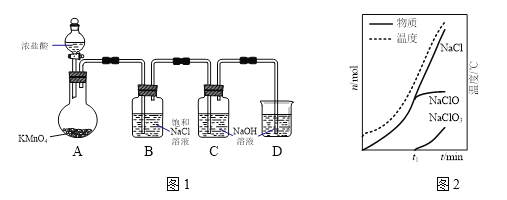
(1)装置C中生成各物质的物质的量和溶液的温度随时间的变化如图乙所示。t1分钟后所发生主要反应的化学方程式为________________________。
(2)如果要减少NaClO3的生成,可以采取的方法是_________、___________(填两种)。
(3)由装置C中的溶液得到次氯酸钠样品。假设该次氯酸钠样品中混有的杂质为NaClO3或NaCl中的一种。称取2.0225 g样品于锥形瓶中,加水使其完全溶解,向溶液中加入200 mL 0.60 mol·L-1的FeSO4溶液(过量),充分反应。再向溶液中滴加0.50 mol·L-1的KMnO4溶液,恰好完全反应时消耗KMnO4溶液20.00 mL。请计算样品中NaClO的质量分数____________(写出计算过程)。
已知:H++ClO-+Fe2+→Cl-+Fe3++H2O
H++ClO3-+Fe2+→Cl-+Fe3++H2O
H++MnO4-+Fe2+→Mn2++Fe3++H2O(以上反应均未配平)
-
“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定
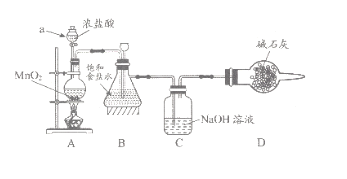
(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:1.饱和NaClO溶液pH为11;
2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
| B瓶 | C瓶 |
| 实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
| 实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_____,装置A中发生反应的离子方程式________。
②实验1中B瓶溶液中产生现象的原因是_________。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______。
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤Ⅰ的C瓶中发生反应的离子方程式为_______。
②步骤Ⅱ通常选用___作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_____g/L(保留2位小数)
-
“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
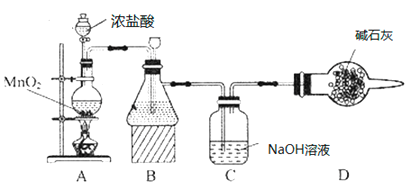
(1)该学习小组按如图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
| 实验步骤 | 实验现象 |
| B瓶 | C瓶 |
| 实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
| 实验2:测定溶液的pH | 3 | 12 |
已知:①饱和NaClO溶液pH为11;②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8。回答下列问题:
①装置B盛装的试剂是___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中C瓶溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的锥形瓶中发生反应的离子方程式为_________。
②滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
-
某品牌的家用消毒剂其有效成分对氯间二甲苯酚(结构简式如下图所示),可以杀灭常见的病毒与细菌。下面有关物质的说法正确的是

A. A B. B C. C D. D
-
某品牌的家用消毒剂其有效成分为对氯间二甲苯酚(结构简式如下图所示),可以杀灭常见 的病毒与细菌。下面有关该物质的说法正确的是
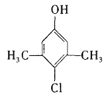
A.该物质的分子式是C8H10ClO
B.1mol该物质最多可以与2mol NaOH反应
C.1mol该物质可以与2mol液溴发生取代反应
D.该物质可以发生加成、取代、消去、氧化等反应
-
“84消毒液”在日常生活中被广泛使用,该消毒液无色,pH大于7,对某些有色物质有漂白作用。已知,强酸弱碱形成的盐溶液呈酸性,则你认为“84消毒液”的有效成分是( )
A. 氯化氢 B. 次氯酸钠 C. 高锰酸钾 D. 碳酸钠
-
84消毒液(有效成分是次氯酸钠)、漂白粉(有效成分是次氯酸钙)等物质是日常生活中常用的消毒剂,广泛应用于日常生活中。根据下列要求回答相关问题:
(1)在0.1 mol·L-1的84消毒液中滴加几滴酚酞试液,可能观察到的现象是______________,写出反应的离子方程式:______________________________。
(2)某同学测定漂白粉溶液pH的操作方法:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液滴在试纸上,大约半分钟后,再与标准比色卡对照。你认为他能否达到实验目的?________(填“能”或“否”)。
(3)下列关于0.5 mol·L-1 NaClO溶液中各粒子浓度的关系式正确的是____________。
A.c(OH-)>c(H+)>c(Na+)>c(ClO-) B.c(Na+)=c(ClO-)+c(HClO)
C.c(Na+)>c(ClO-)>c(OH-)>c(H+) D.c(Na+)+c(H+)=c(ClO-)
-
“84”消毒液的成分是NaClO,某化学研究性学习小组在实验室制备NaClO并探究其性质。
(1)该学习小组用如图装置进行实验(部分夹持装置略去),反应一段时间后,取C瓶中的溶液进行实验,测得溶液的pH=12。
(查阅资料:饱和NaClO溶液pH为11)。
回答下列问题:
①装置A中发生反应的离子方程式为_______________________________。
②B装置的作用是__________________。
③C瓶溶液中的溶质是NaCl、______________(填化学式)。
(2)实验结束后,在m处最好连接盛________(填“NaOH 溶液”或“水”) 的注射器,然后打开K1关闭K2,最后再拆除装置。
(3)测定C瓶溶液中NaClO含量的实验步骤如下:
步骤1:将C瓶溶液加入硫酸酸化,加入过量KI溶液,塞紧瓶塞并在暗处充分反应后滴入5~6滴淀粉溶液。
步骤2:分两次各取步骤1的溶液20mL于锥形瓶中,用0.1000mol·L-1 Na2S2O3 标准溶液滴定,滴定终点时两次耗Na2S2O3 溶液体积的平均值为16.00mL。(已知:I2+2S2O32- =2I-+S4O62-)
①步骤1的C瓶中发生反应的离子方程式为:___________________________________。
②滴定终点的现象为______________________________________________________。
③塞紧瓶塞并在暗处反应的原因是_____________________________________。
④C瓶溶液中NaClO含量为____________g·L-1。
⑤若盛Na2S2O3 标准溶液的滴定管未用Na2S2O3 标准溶液润洗,则测得C瓶溶液中NaClO含量__________(填“偏大”、“偏小”或“不变”)。
-
(1)“84”消毒液是一种常用的消毒剂,其有效成分是______(填化学式)。某学生用石墨作电极电解饱和氯化钠溶液,制作了一种家用环保型消毒液发生器,如图所示。电极c处发生反应的离子方程式依次为:2H2O+2e-=H2↑+2OH-;_____。
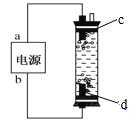
(2)“84”消毒液工业品中常含有1.5%~3%的NaOH,其目的一是使平衡_____(写出离子方程式)向逆方向移动;二是吸收空气中的_____(填化学式)防止消毒液失效。
(3)消毒液中氯元素的存在形态与溶液pH的关系如下:
| 溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
| 主要成分 | NaClO | HClO与NaClO(少量) | HClO与Cl2(少量) | HClO与Cl2 | Cl2 |
请你写出pH降低时产生氯气的离子方程式:_____。
(4)某同学猜测“84消毒液”(以下简称“84”)可以“漂白”米醋,进行了实验1和实验2:
| 编号 | 实验操作 | 实验现象 |
| 实验1 | 
滴加2滴米醋,5滴管“84” | 溶液无色,闻到刺激性气味 |
| 实验2 | 
滴加2滴米醋,5滴管蒸馏水 | 溶液为浅棕色,无刺激性气味 |
实验2的目的是:①______;②______。
为进一步研究“84”与米醋的反应,该同学又进行了以下实验:
| 编号 | 实验操作 | 实验现象 |
| 实验3 | 
逐滴加入“84”,10滴米醋 | “84”滴入后迅速产生刺激性气味的气体;滴加至5滴时,溶液开始褪色;滴加至21滴时,褪为淡黄色;继续滴加不再出现明显褪色。 |
| 实验4 | 
逐滴加入米醋,21滴“84” | 滴入米醋后立即褪色;当米醋滴加至10滴时,溶液较实验3颜色更浅;当米醋加至17滴时,与实验3中溶液最终颜色相同。 |
请你结合上述实验和相关资料,分析实验3与实验4现象的差异:______。
(5)某工厂使用次氯酸钠漂白棉布,该工厂对生产条件进行了研究,结果如图所示:
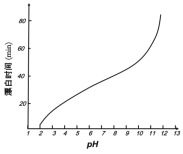
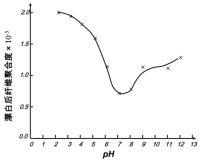
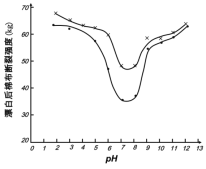
查阅资料得知:次氯酸钠对纤维素的破坏分为两个阶段进行。第一阶段:纤维素纤维的羟基与次氯酸作用生成次氯酸酯;第二阶段:生成的次氯酸酯在OH-离子作用下,失去一分子氯化氢,并转变为醛或酮,直接影响纤维素化学键的稳定性。
①当溶液pH=7时,纤维聚合度最低,纤维损伤最严重的原因是:_____。
②综合考虑,生产过程中pH最好选择_____,理由是_____。
-
家用氯漂白剂的有效成分是NaClO,除用于漂白衣物、消除污渍外,在食品加工中也广泛应用。
Ⅰ.(1)常温下,一定浓度次氯酸钠水溶液的pH=a,则a______7(填>、<或=);结合离子方程式解释其原因是__________________________________________________,此时,溶液中由水电离出的c(OH-)=________mol/L。
(2)漂白剂与酸混合后效果更佳,将0.1000mol/L NaClO溶液与0.1000mol/L 硫酸溶液等体积混合后,关于所得溶液的以下分析正确的是____________(忽略HClO的分解;HSO4-的电离视为完全)。
A.c(HClO)+c(ClO-)=0.1000mol/L
B.c(H+)>c(Na+)=c(SO42-)>c(HClO)>c(ClO-)>c(OH-)
C.c(Na+)+c(H+)=c(SO42-)+c(ClO-)+c(OH-)
D.c(H+)-c(OH-)=2c(ClO-)+c(HClO)
Ⅱ.取20.00g家用氯漂白剂溶液配制成100mL溶液,取出10mL,加入过量KI处理,用足量稀硫酸酸化,然后立即用0.1000mol/L Na2S2O3溶液滴定生成的I2(2Na2S2O3+I2=2I-+Na2S4O6),指示剂显示滴定终点时,消耗Na2S2O3溶液30.00 mL;
(1)用KI处理漂白剂生成I2的离子方程式为________________________________。
(2)该滴定过程选用的指示剂通常为___________,判断滴定终点时的现象是___________________________________________________________________________。
(3)该漂白剂中“有效氯”的含量为_________________(结果保留一位小数)。若滴定结束时,发现滴定管尖嘴部分有气泡,则测定结果________(填“偏高”“偏低”“无影响”)。
注:“有效氯”指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。












