-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
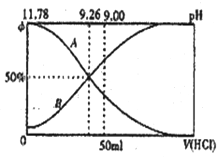
Ⅰ.常温下向100 mL 0.2 mol·L-l的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体枳的关系如图所示,根据图象回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是______(填“A”或“B”)。
(2)NH3·H2O的电离常数为______(已知 lg1.8=0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=____mol·L-1(用数字表示精确值)。
Ⅱ.若液氨中也存在类似水的电离(H2O+H2O H3O++OH-),写出液氨的电离方程式__________________________。
H3O++OH-),写出液氨的电离方程式__________________________。
III.氨是一种重要的化工原料,可以用来制备肼(N2H4)。肼的制备方法是用次氯酸钠氧化过量的氨。 已知ClO-水解的方程式为:ClO-+H2O HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaClO溶液的pH=________。
HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaClO溶液的pH=________。
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
Ⅰ.常温下向100 mL 0.2 mol·L-l的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体枳的关系如图所示,根据图象回答下列问题。
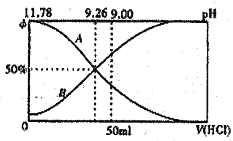
(1)表示NH3·H2O浓度变化的曲銭是____________(填“A”或“B”)。
(2)NH3·H2O的电离常数为____________ (已知 lg1.8=0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)·c(NH3·H2O)=____________mol·L-1(用数字表示精确值)。
Ⅱ.若液氨中也存在类似水的电离(H2O+H2O H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式__________________________。
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式____________________________________。
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________________________________。
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
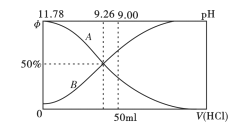
(1)表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
(2)NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
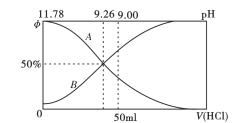
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶被中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是______。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100m10.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
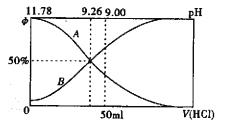
①表示NH3·H2O浓度变化的曲线是______(填“ A”或“B")。
②NH3·H2O 的电离常数为_______(已知1g1.8=0.26)
③当加入盐酸体积为50ml 时,溶液中c(NH4+)-c(NH3·H2O)=____mol/L (用精确值表示)。
II.已知常温下,Ksp[Al(OH)3]=4.0×10-38,在AlCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:________________;若将所得悬浊液的pH 调整为3,则溶液中Al3+浓度为_____mol/L。
-
工业排放的烟气中的SO2是大气的一次污染物之一,同时也是雾篮天气的重要前体物。工业上常用氨水吸二氧化硫气体。常温时,向10mL0.1mol•L-l的氨水中通入SO2,SO2体积(标准状况)与溶液pH的关系如图所示(忽略溶液体积变化)。
已知:25℃时,NH3•H2O的Kb=l.7×l0-5,H2SO3的Ka1=l.3×10-2,Ka2=6.2×l0-8。
回答下列问题:
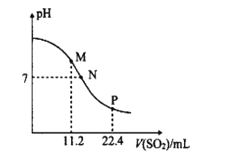
(1)M点溶液中阴离子浓度由大到小的顺序为__, __(填>、=或<)2。
__(填>、=或<)2。
(2)N点溶液中的溶质为__(填化学式),c(NH4+):c(HSO3-)=__。
(3)水的电离程度M点__P点(填“大于”、“小于”或“等于”)。
(4)反应NH3•H2O+H2SO3 NH4++HSO3-+H2O的平衡常数K=__。
NH4++HSO3-+H2O的平衡常数K=__。
-
甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。
(1)已知反应CO(g)+2H2(g)== CH3OH(g) ∆H= —99kJ.mol—1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | x | 465 | 413 |
则x=___________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) CH3OH(g) ,
CH3OH(g) ,
CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(b)____v(a)(填“>”、“<”或“=”)。②该反应的△S______0,图中的T1______T2(填“>”、“<”或“=”)。

③该合成反应的温度一般控制在240~270℃,选择此温度范围的原因是:
I.此温度范围下的催化剂活性高;
II.______________________________________________________。
④图中a点的压强平衡常数KP=_______________(KPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g) CH3OH(g) ∆H1
CH3OH(g) ∆H1
II:CO2(g)+H2(g)  CO(g) + H2O(g) ∆H2
CO(g) + H2O(g) ∆H2
III:CO2(g)+3H2(g) CH3OH(g) + H2O(g) ∆H3
CH3OH(g) + H2O(g) ∆H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如下图所示。

则∆H1___________∆H3(填“>”、“<”或“=”), 理由是__________________________。
-
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用。
(1)液氨储氢是目前研究的重要课题。液氨的电离和水的电离相似,液氨中的氨也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为1.0×10-30。现将2.3克金属钠投入1.0 L 液氨中,待反应结束后,假设溶液体积不变,所得溶液中NH4+离子浓度为 。
NH4++NH2-,其离子积常数为1.0×10-30。现将2.3克金属钠投入1.0 L 液氨中,待反应结束后,假设溶液体积不变,所得溶液中NH4+离子浓度为 。
(2)用Pt电极对液氨进行电解可产生H2和N2,则阴极的电极反应式是 。
(3)用NH3催化还原NXOy可以消除氮氧化合物的污染。请写出氨气催化还原NO的化学方程式 。
(4)将一定量的N2和H2充入1L的密闭容器中,在500℃、2×107Pa下反应并达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol,则H2的平衡转化率为 ;在该温度下的平衡常数K= 。
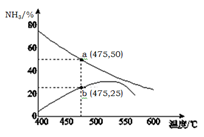
(5 )右图是某压强下,N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。则图中b点,v(正) v(逆)。(填“>”、
)右图是某压强下,N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。则图中b点,v(正) v(逆)。(填“>”、 “=”或“<”)
“=”或“<”)
-
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.实验室中制备硝基苯的过程如下:
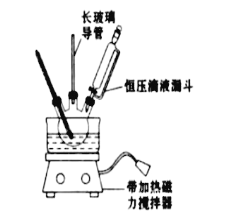
①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合酸,加入恒压滴液漏斗中.把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③加热在50~60℃下发生反应,直至反说结束.
④除去混合酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后用蒸馏水洗涤得到粗产品.
⑤为了得到更纯净的硝基苯.还需先向液棒中加入试剂A,静置一段时间后弃去试剂A,然后蒸馏,最终得到17.5g硝基苯
已知:
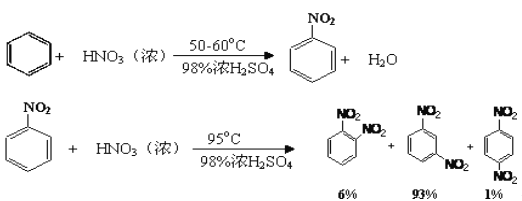
可能用到的有关数据列表如下:
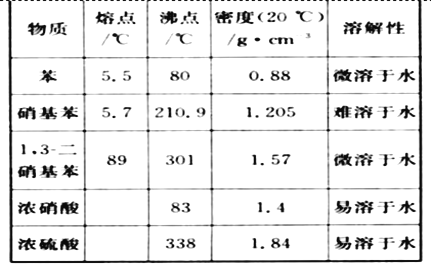
请回答下列问题:
(1)配制混酸应先在烧杯中加入_______.
(2)恒压滴液漏斗的优点是_______,实验装置中长玻璃导管可用____________代替(填仪器名称)
(3)要控制反应温度50~60℃,可用水浴加热,其优点为___________________________
(4)反应结束后产品在液体的_____层(填"上"或"下"),分离混酸和产品的操作方法为____________
(5)用10% Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?___________
(6)试剂A是________,蒸馏过程中需在蒸馏烧瓶中加入沸石,其作用为_______________若加热后,发现未加沸石,应采取的正确方法______________________________________
(7)硝基苯的产率为_________.
-
硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
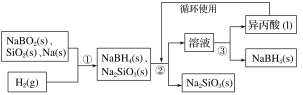
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:33 ℃)。
(1)在第①步反应加料之前,需要将反应器加热至100 ℃以上并通入氩气,该操作的目的是______________,原料中的金属钠通常保存在________中,实验室取用少量金属钠需要用到的实验用品有________、________、玻璃片和小刀等。
(2)第②步分离采用的方法是________;第③步分离(NaBH4)并回收溶剂,采用的方法是________。

H3O++OH-),写出液氨的电离方程式__________________________。
HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaClO溶液的pH=________。











