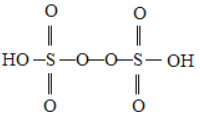-
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用。
(1)液氨储氢是目前研究的重要课题。液氨的电离和水的电离相似,液氨中的氨也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为1.0×10-30。现将2.3克金属钠投入1.0 L 液氨中,待反应结束后,假设溶液体积不变,所得溶液中NH4+离子浓度为 。
NH4++NH2-,其离子积常数为1.0×10-30。现将2.3克金属钠投入1.0 L 液氨中,待反应结束后,假设溶液体积不变,所得溶液中NH4+离子浓度为 。
(2)用Pt电极对液氨进行电解可产生H2和N2,则阴极的电极反应式是 。
(3)用NH3催化还原NXOy可以消除氮氧化合物的污染。请写出氨气催化还原NO的化学方程式 。
(4)将一定量的N2和H2充入1L的密闭容器中,在500℃、2×107Pa下反应并达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol,则H2的平衡转化率为 ;在该温度下的平衡常数K= 。
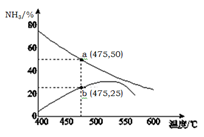
(5 )右图是某压强下,N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。则图中b点,v(正) v(逆)。(填“>”、
)右图是某压强下,N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。则图中b点,v(正) v(逆)。(填“>”、 “=”或“<”)
“=”或“<”)
-
化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。
(1)钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O 2MnO4—+10SO42—+16H+
2MnO4—+10SO42—+16H+
①基态S原子核外有____种不同空间运动状态的电子。
②已知H2S2O8的结构如图所示:
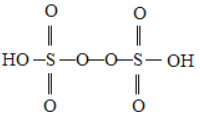
H2S2O8中硫原子的轨道杂化方式为________;上述反应每生成1molMnO4—,S2O82—断裂的共价键类型及其数目分别为________、__________(设阿伏伽德罗常数的值为NA)
(2)Fe可以与CN—、H2NCONH2(尿素)等多种配体形成配合物。
①请写出与CN—互为等电子体的一种分子:______、一种离子:_________。
②组成尿素的第二周期元素的第一电离能由大到小的顺序为:________,1molH2NCONH2(尿素)分子中含有σ键的数目为_______。
③FeN的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x—n)CunNy。
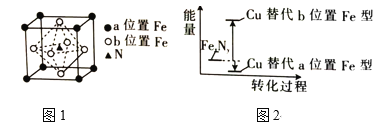
Cu处于周期表中_____区,其最高能层的符号为____,基态铜原子的价电子排布式为________。FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为_________。
(3)铬是银灰色的结晶体,质硬而脆,是制造不锈钢、高速钢的重要原料。
①CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是____(填“极性”或“非极性”)分子
②CrCl3·6H2O实际上是配合物,配位数是6,其固体有三种颜色,其中一种浅绿色固体于足量硝酸银反应时,1mol固体可生成1molAgCl沉淀,则这种浅绿色固体中阳离子的化学式为_______。
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
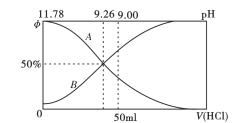
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶被中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是______。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100m10.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
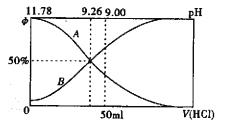
①表示NH3·H2O浓度变化的曲线是______(填“ A”或“B")。
②NH3·H2O 的电离常数为_______(已知1g1.8=0.26)
③当加入盐酸体积为50ml 时,溶液中c(NH4+)-c(NH3·H2O)=____mol/L (用精确值表示)。
II.已知常温下,Ksp[Al(OH)3]=4.0×10-38,在AlCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:________________;若将所得悬浊液的pH 调整为3,则溶液中Al3+浓度为_____mol/L。
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
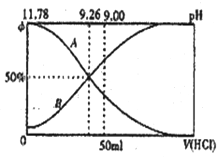
Ⅰ.常温下向100 mL 0.2 mol·L-l的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体枳的关系如图所示,根据图象回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是______(填“A”或“B”)。
(2)NH3·H2O的电离常数为______(已知 lg1.8=0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=____mol·L-1(用数字表示精确值)。
Ⅱ.若液氨中也存在类似水的电离(H2O+H2O H3O++OH-),写出液氨的电离方程式__________________________。
H3O++OH-),写出液氨的电离方程式__________________________。
III.氨是一种重要的化工原料,可以用来制备肼(N2H4)。肼的制备方法是用次氯酸钠氧化过量的氨。 已知ClO-水解的方程式为:ClO-+H2O HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaClO溶液的pH=________。
HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaClO溶液的pH=________。
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
Ⅰ.常温下向100 mL 0.2 mol·L-l的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体枳的关系如图所示,根据图象回答下列问题。
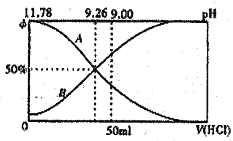
(1)表示NH3·H2O浓度变化的曲銭是____________(填“A”或“B”)。
(2)NH3·H2O的电离常数为____________ (已知 lg1.8=0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)·c(NH3·H2O)=____________mol·L-1(用数字表示精确值)。
Ⅱ.若液氨中也存在类似水的电离(H2O+H2O H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式__________________________。
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式____________________________________。
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________________________________。
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
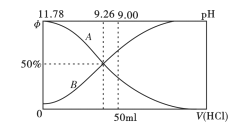
(1)表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
(2)NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
-
(11分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应。
(1)当反应达到平衡时,N2和H2的浓度比是 ,N2和H2的转化率比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍.
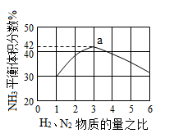
(5)下图表示工业500℃、60.0MPa条件下合成氨,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:___ ___。
(6)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH)=c(Cl-);用含a的代数式表示NH3·H2O的电离常数Kb=_________________。
-
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中的位置为_____________,NF3的分子立体构型名称是____________。类比NH3·H2O表示出代表性分子NH4F含有的氢键________________________。
(2)写出N2O的等电子体__________________(1个分子和1个离子)。
(3)Cu原子的基态外围电子排布式为____________;已知:CuO在高温下会分解成Cu2O,试从洪特规则角度解释其原因__________________________________________________。
(4) 在Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中H—C=O的键角______(填“大于”“等于”或“小于”)乙醇分子中的H—C—O的键角。
(5) 某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。其水溶液中的N4H44+遇碱生成一种形似白磷的N4分子。画出N4H44+的结构式(标明其中的配位键)__________________。
-
Cu3N具有良好的电学和光学性能,在电子工业领城、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用。
(1)Cu+的核外电子排布式为__________;N元素与O元素的第一电离能比较:N____O(填“>”、“<”或“=”)。
(2)与N3-含有相同电子数的四原子分子的空间构型为____________________。
(3)在Cu催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中醛其( )碳原子的杂化方式为_________。
)碳原子的杂化方式为_________。
(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被C1-取代可生成Cu(H2O)2Cl2,试画出其具有极性的分子的结构式________________。
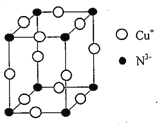
(5)Cu3N的晶胞结构如图所示,N3-的配位数为________;若晶胞棱长为anm,NA表示阿伏加德罗常数的值,则Cu3N的密度p=______g/cm3 [用含a 和NA 的式子表示,Mr(Cu3N)=206]
NH4++NH2-,其离子积常数为1.0×10-30。现将2.3克金属钠投入1.0 L 液氨中,待反应结束后,假设溶液体积不变,所得溶液中NH4+离子浓度为 。

)右图是某压强下,N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。则图中b点,v(正) v(逆)。(填“>”、
“=”或“<”)