-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
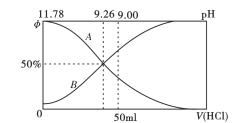
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶被中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是______。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100m10.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
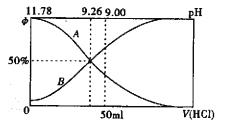
①表示NH3·H2O浓度变化的曲线是______(填“ A”或“B")。
②NH3·H2O 的电离常数为_______(已知1g1.8=0.26)
③当加入盐酸体积为50ml 时,溶液中c(NH4+)-c(NH3·H2O)=____mol/L (用精确值表示)。
II.已知常温下,Ksp[Al(OH)3]=4.0×10-38,在AlCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:________________;若将所得悬浊液的pH 调整为3,则溶液中Al3+浓度为_____mol/L。
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
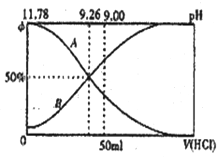
Ⅰ.常温下向100 mL 0.2 mol·L-l的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体枳的关系如图所示,根据图象回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是______(填“A”或“B”)。
(2)NH3·H2O的电离常数为______(已知 lg1.8=0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=____mol·L-1(用数字表示精确值)。
Ⅱ.若液氨中也存在类似水的电离(H2O+H2O H3O++OH-),写出液氨的电离方程式__________________________。
H3O++OH-),写出液氨的电离方程式__________________________。
III.氨是一种重要的化工原料,可以用来制备肼(N2H4)。肼的制备方法是用次氯酸钠氧化过量的氨。 已知ClO-水解的方程式为:ClO-+H2O HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaClO溶液的pH=________。
HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaClO溶液的pH=________。
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
Ⅰ.常温下向100 mL 0.2 mol·L-l的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体枳的关系如图所示,根据图象回答下列问题。
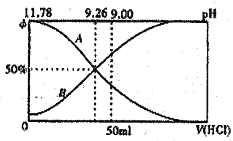
(1)表示NH3·H2O浓度变化的曲銭是____________(填“A”或“B”)。
(2)NH3·H2O的电离常数为____________ (已知 lg1.8=0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)·c(NH3·H2O)=____________mol·L-1(用数字表示精确值)。
Ⅱ.若液氨中也存在类似水的电离(H2O+H2O H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式__________________________。
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式____________________________________。
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________________________________。
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
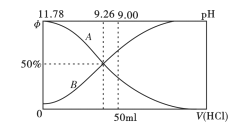
(1)表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
(2)NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
-
I.甲醇应用于精细化工,塑料等领域,是基础的有机化工原料和优质燃料。工业上利用H2、CO和CO2等气体体系在催化剂条件下合成甲醇(CH3OH)。主要反应:
①CO(g)+2H2(g) CH3OH(g) △H=-91 kJ·mol—1
CH3OH(g) △H=-91 kJ·mol—1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49 kJ·mol—1
CH3OH(g)+H2O(g) △H=-49 kJ·mol—1
副反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-206 kJ·mol—1
CH3OCH3(g)+H2O(g) △H=-206 kJ·mol—1
(1)写出反应②平衡常数的表达式____________________________。
(2)工业上可利用CH3OH(g)制备CH3OCH3(g),写出热化学方程式___________________。
(3)生产中H2和CO按物质的量比为10:1投料,假设在反应容器中投入1molCO和10molH2在某温度下反应(只考虑反应①),达到平衡后,测得甲醇的物质的量分数为5%,则CO的转化率为_____________。
(4)工业中常用甲醇为燃料制成燃料电池,请写出在KOH(aq)介质中该电池负极的电极反应式_________________________________________________________。
Ⅱ.能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应原理为:CO(g)+2H2(g)⇌CH3OH(g) △H。
下表所列数据是该反应在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(1)根据表中数据可判断△H_______0 (填“>”、“=”或“<”).
(2)300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将____(填序号):
A.正向移动 B.逆向移动 C.处于平衡状态 D.无法判断
(3)下列能说明上述反应达到化学平衡状态的标志是__________
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产n molCO同时生成2n molH2
-
过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2  CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如下:

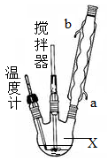
请回答下列问题:
(1)仪器X的名称是 ;冷凝管中冷却水从 (填“a”或“b”)口进入;
(2)反应器的加热方式是 。
(3)搅拌器是否可用铁质材料 (填“是”或“否”),原因是 ;
(4)步骤①采用减压蒸发的原因是 。
(5)母液可以循环使用提高原料利用率,若欲从母液中分离出H2O2和尿素, 可采用的操作是
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL6mol·L-1H2SO4,用0.1000mol•L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量 (填“偏高”、“偏低”或“不变”)。
-
过氧化尿素广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2  CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程如下:
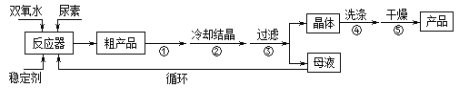
请回答下列问题:
(1)该反应的温度不能过低或过高的原因是___________
(2)步骤①宜采用的操作是____________。
(3)称取10.0g产品溶解在250mL蒸馏水中,移取25mL溶解后的溶液于锥形瓶中,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应).
①配制0.2000mol·L﹣1KMnO4 标准溶液不需要用到的仪器有_______(填编号)
a.托盘天平 b.电子天平 c. 滴定管 d. 烧杯 e. 锥形瓶 f. 玻璃棒 g. 胶头滴管
②用0.2000mol·L﹣1KMnO4标准溶液滴定,其中正确操作步骤的顺序为_________
a. 用移液管取用25mL待测溶液于锥形瓶中
b. 把盛有KMnO4标准液的滴定管固定好,调节滴定管尖嘴使之充满液体
c. 取KMnO4标准液注入滴定管中至“0”刻度以上
d. 调节液面至“0”或“0”刻度以下,记下读数 e.把锥形瓶放在滴定管下面,用标准KMnO4液滴定至终点并记下滴定管的读数
③下列操作中的说法正确的是_________
A. KMnO4标准溶液放在酸式滴定管中
B. 滴定前,锥形瓶必须用待装液润洗
C. 滴定过程中需要用酚酞作指示剂
D. 滴定操作中,如果滴定前装有KMnO4标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将偏大
④为提高该滴定结果的精密度和准确度,可采取的措施是__________
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
-
过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:
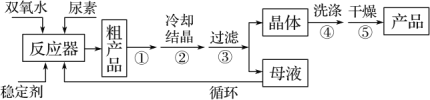
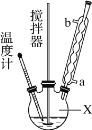
请回答下列问题:
(1)仪器X的名称是______,冷凝管中冷却水从______ (填“a”或“b”)口出来。
(2)该反应的温度控制30℃而不能过高的原因是______。
(3)步骤①宜采用的操作是______ (填字母)。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是______。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L-1H2SO4,用0.2000mol·L-1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为______(保留四位有效数字)。若滴定后俯视读数,则测得的过氧化尿素含量_____(填“偏高”“偏低”或“不变”)。
-
过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:
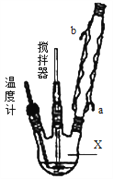

请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。

H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。










