-
(16分)工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。

(1)写出N2的一种用途 。
(2)实验室制取物质NH3的化学方程式为 。
(3)写出工业制硝酸第③步反应化学方程式 。
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(ⅰ)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:___________ 。该反应中发生氧化反应的物质是_______,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(ⅱ)48.0 g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4 L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(ⅲ)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______  ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并配平其对应的离子方程式:□Fe2++□NO3-+□H+ =□Fe3++□N2O↑+□H2O
-
工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。

(1)写出N2的一种用途_____________________。
(2)工业合成NH3的化学方程式为______________________。
(3)写出工业制硝酸第③步反应化学方程式_____________________。
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(ⅰ)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:____________。该反应中发生氧化反应的物质是_______,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(ⅱ)64.0 g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4 L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是(______)
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(ⅲ)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______  ______ + ______ + N2O↑ + H2O(2分)
______ + ______ + N2O↑ + H2O(2分)
并配平其对应的离子方程式:__Fe2++__NO3-+__H+ =__Fe3++__N2O↑+__H2O
-
工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。下图路线中的①-③、Ⅰ-Ⅲ分别是工业生产硝酸和雷电高能固氮过程中硝酸的生成途径。回答下列问题:

(1)雷电高能固氮生产硝酸的三个反应中,是否均为氧化还原反应?_______。
(2)图中途径I、①和②对应的三个反应中,常温下就能进行的是途径________。
(3)途径③对应的反应为NO2+H2O—HNO3+NO(未配平),该反应过程中氧化产物和还原产物的物质的量之比为__________________。
(4)硝酸必须保存于棕色瓶里并置于阴凉处的原因是____________________;可用铝质或铁质容器盛放冷的浓硝酸的原因是_____________________。
(5)硝酸的用途之一是与氨气反应制硝酸铵,其化学方程式为_____________。
-
关于氮的变化关系图如下:

则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线ⅠⅡ Ⅲ是雷电固氮生成硝酸的主要途径
C.氮气可在足量的氧气中通过一步反应生成NO2
D.上述所有反应都是氧化还原反应
-
关于氮的变化关系图如图:
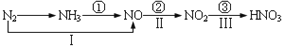
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.上述路线的所有反应中只有I属于氮的固定
-
关于氮的变化关系图如下,则下列说法不正确的是
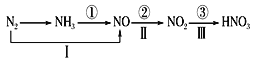
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气在足量的氧气中通过一步反应可生成NO2
-
关于氮的变化关系图如下,则下列说法不正确的是
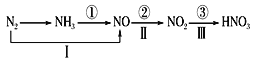
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气在足量的氧气中通过一步反应可生成NO2
-
现有氮及其化合物的转化关系如下图,则下列说法错误的是
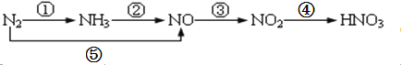
A.路线①②⑤均能表示氮的固定
B.路线②③④是工业生产硝酸的主要途径
C.路线⑤③④是“雷雨发庄稼”的主要途径
D.上述所有反应都是氧化还原反应
-
氨催化氧化法制硝酸是工业生产硝酸的主要途径,某同学利用该原理在实验室探究硝酸的制备和性质,设计了如图所示装置。
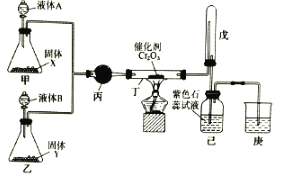
回答下列问题:
(1)甲、乙两装置分别制取氨气和氧气。盛装液体A、B的仪器名称为__。若固体X是NaOH,则液体A为__(填名称);若Y是淡黄色固体、B为纯净物,则液体B为__(填化学式);若固体Y是MnO2,则液体B为__(填化学式)。
(2)丁中发生反应的化学方程式为__。
(3)装置戊的作用是__。
(4)为防止过量的氨气影响硝酸的制备和性质实验,可在丁、戊之间添加一个U型干燥管,其中盛装的试剂可以是下列中的__。(填标号)
A.碱石灰
B.生石灰
C.浓硫酸
D.无水氯化钙
(5)改装后,实验中观察到戊装置中的气体变为红棕色,己瓶中溶液颜色变红。若通入到己瓶中的红棕色混合气体恰好与水完全反应且无其他气体生成,则己瓶中发生反应的化学方程式为___。
-
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置:

(1)若分液漏斗中氨水的浓度为9.0mol•L﹣1,配制该浓度的氨水100mL,用到的玻璃仪 器有100mL容量瓶、烧杯、玻璃棒、
器有100mL容量瓶、烧杯、玻璃棒、  。
。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 。
(4)当戊中观察到 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 。如何改进置 。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 。
______ + ______ + N2O↑ + H2O






