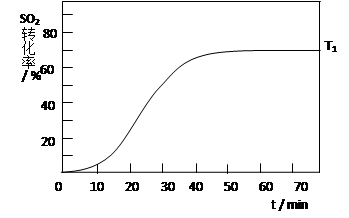-
(14分)某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应:
4FeS2+11O2 2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。

实验步骤:称取研细的样品4.000g放入上图b装置中,然后在空气中进行煅烧。为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10mL置于锥形瓶里,用0.1000mol/L草酸(H2C2O4)标准溶液进行滴定。
(已知:5SO2 + 2KMnO4 + 2H2O == K2SO4 + 2MnSO4 + 2H2SO4 )
请回答下列问题:
(1)称量样品质量能否用托盘天平________(填“能”或“不能”);
(2)装置a的作用是________ ________;
(3)上述反应结束后,仍需通一段时间的空气,其目的是 ;
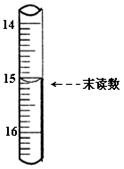
(4)滴定时,发生反应的离子方程式为________,已知滴定管初读数为0.10mL,末读数如上图所示,消耗草酸溶液的体积为 ________mL;
(5)该样品中FeS2的纯度为;
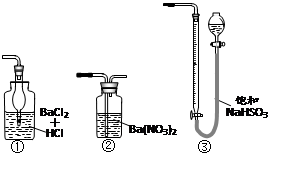
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是________。(填编号)
-
黄铁矿是生产硫酸的原料,其主要成分为FeS2。850〜950℃时,在空气中煅烧,发生反应
4FeS2 + 11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
试回答下列问题:
(1)含硫35%的黄铁矿样品(杂质不含硫),其FeS2的含量为_____________
(2)可用来表示该反应的化学反应速率的物质为_________________(填化学式)。
(3)某时刻测得生成SO2的速率为0.64 mol·L-1·s-1,则氧气减少的速率为_____________
(4)为了提高SO2的生成速率,下列措施可行的是______________(填选项字母)。
A.增加硫铁矿石的投入量 B.增加炉的高度
C.将硫铁矿石粉碎 D.升高温度
-
工业上制硫酸的主要反应如下:4FeS2+11O2═2Fe2O3+8SO2; 2SO2+O2
 2SO3; SO3+H2O═H2SO4用含FeS280%的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失率为2%.求生产500t98%的硫酸需矿石的质量.(要写出简单计算过程)
2SO3; SO3+H2O═H2SO4用含FeS280%的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失率为2%.求生产500t98%的硫酸需矿石的质量.(要写出简单计算过程)
-
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~950℃时,空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):4FeS2+11O2→2Fe2O3+8SO2
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为 。
(2)设1t纯净的FeS2完全反应,产生标准状况下SO2 m3。
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少?
-
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等.实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如图:
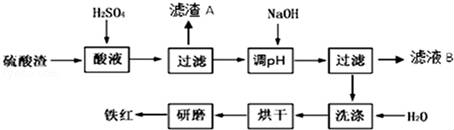
(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: .
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是 (部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 .
(4)如何证明洗涤环节充分洗净 .
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 .(用题中所给数据计算并用最简整数比表示结果)
-
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
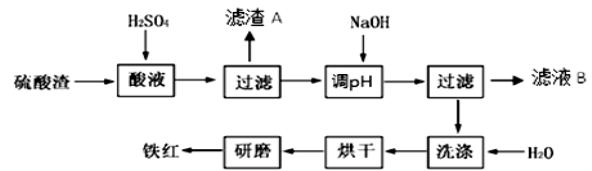
(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: 。
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 。
(4)如何证明洗涤环节充分洗净 。
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 。(用题中所给数据计算并用最简整数比表示结果)
-
煅烧硫铁矿石(主要成分是FeS2),可获得制取硫酸所需的SO2,反应方程式为:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2,为了提高SO2的生成速率,下列措施可行的 ( )
A.增加硫铁矿石的投入量 B.增加炉的高度
C.降低温度 D.升高温度
-
工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料-----铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为_____________________________;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有___________、玻璃棒和烧杯等;步骤Ⅳ中应选用______试剂调节溶液的pH(填字母编号)
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是________________;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是________________;
(5)步骤Ⅵ中发生反应的化学反应方程式为_____________________________;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol•L-1.试判断所得的FeCO3中是否含有Fe(OH)2__________(填“是”或“否”),请通过简单计算说明理由__________________________(已知:Ksp[Fe(OH)2]=4.9×10-17)。
-
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
______________________________________________________________。
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是________。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.改变反应的催化剂 D.降低反应的温度
(4)反应:2SO2(g)+O2(g) 2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
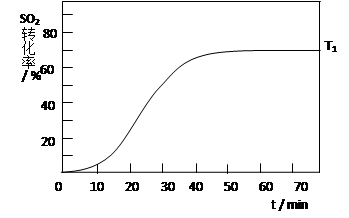
-
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe2O3。
(1)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率________、________。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率________、________。

(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有________(填字母序号,多选倒扣分)。
A.升高温度 B.降低温度
C.增大压强 D.加入催化剂
E.移出氧气
(3)某温度下,上述反应中SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。判断:平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”)。
2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。