-
很多含氯化合物都是重要的漂白剂
Ⅰ、亚氯酸钠(NaClO2)是一种常见漂白剂,某探究小组开展如下实验,回答下列问题:
制取NaClO2晶体按如下图装置进行制取。
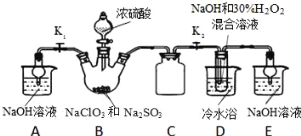
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是_____________;
(2)已知装置B中的产物有ClO2气体,则装置D中反应生成NaClO2的化学方程式为___________________;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是______;检验该离子的方法是____________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______________。
Ⅱ、ClO2也是一种常见漂白剂,用ClO2处理过的饮用水常含有一定量有害的ClO 。我国规定饮用水中ClO
。我国规定饮用水中ClO 的含量应不超过0.20 mg·L-1。测定水样中ClO2、ClO
的含量应不超过0.20 mg·L-1。测定水样中ClO2、ClO 的含量的过程如下:
的含量的过程如下:
①量取25.00 mL水样加入到锥形瓶中,并调节水样的pH为7.0~8.0。
②加入足量的KI晶体。此过程发生反应2ClO2+2I-===2ClO +I2。
+I2。
③加入少量淀粉溶液,再向上述溶液中滴加1.00×10-3 mol·L-1 Na2S2O3溶液至溶液蓝色刚好褪去,消耗Na2S2O3溶液7.45 mL。此过程发生反应:2S2O +I2===S4O
+I2===S4O +2I-。
+2I-。
④调节第③步所得溶液至pH≤2.0,此过程发生反应ClO +4H++4I-===Cl-+2I2+2H2O。
+4H++4I-===Cl-+2I2+2H2O。
⑤再向溶液中滴加1.00×10-3 mol·L-1 Na2S2O3溶液至蓝色刚好褪去,消耗Na2S2O3溶液30.00 mL
根据上述数据计算并判断该水样中ClO 的含量是否符合国家规定。
的含量是否符合国家规定。
______________。
-
(13分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
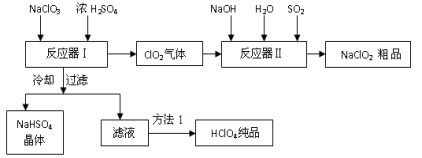
已知:
1.NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
2.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。
请回答下列问题:
(1)反应器Ⅰ中冷却的目的是 ,方法1使用的操作是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成 NaClO2 ,请简要说明双氧水在反应中能 代替SO2的原因是 。
(4)Ca(ClO)2 、ClO2、NaClO、NaClO2 等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有 ,请写出工业上用氯气和NaOH溶液生产另一种消毒剂 NaClO的离子方程式 。
-
NaClO2是一种重要的杀菌消毒剂,消毒时本身被还原成氯离子,也常用来漂白织物等,其一种生产工艺如下:
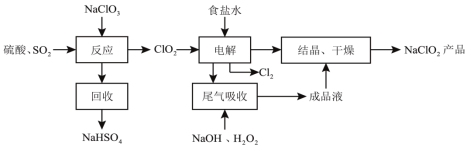
回答下列问题:
(1)NaClO2中Cl的化合价为__________。
(2)写出“反应”步骤中生成ClO2的离子方程式________,该过程体现了SO2的______________( 选填:a 氧化性、b还原性、c漂白性、d酸性氧化物的通性)
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去SO 和Mg2+要加入的试剂分别为__________、__________。“电解”过程的氧化产物是Cl2,则还原产物是_______。
和Mg2+要加入的试剂分别为__________、__________。“电解”过程的氧化产物是Cl2,则还原产物是_______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应的化学方程式为__________,实验室进行结晶操作使用的仪器有铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳和__________。
(5)消毒能力可用单位质量消毒剂得电子多少来衡量。NaClO2与Cl2消毒能力比为___________。(不必化简)。
-
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
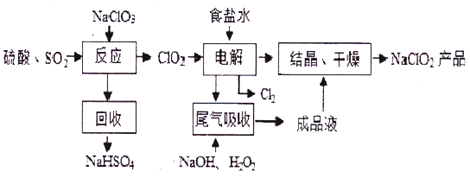
回答下列问题:
(1)NaClO2中Cl的化合价为_________;
(2)写出“反应”步骤中生成ClO2的化学方程式________________________;
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、_______________;
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应中,氧化剂与还原剂的物质的量之比为__________________,该反应中氧化产物是_________________。
-
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
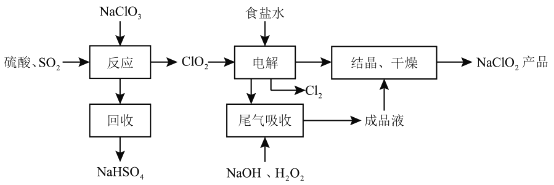
回答下列问题:
(1)NaClO2中 的化合价为__________。
的化合价为__________。
(2)写出“反应”步骤中生成 的化学方程式____________。
的化学方程式____________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 和
和 ,要加入的试剂分别为__________、__________。
,要加入的试剂分别为__________、__________。
(4)“尾气吸收”是吸收“电解”过程排出的少量 ,此吸收反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是____________。
,此吸收反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是____________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。
的氧化能力。 的有效氯含量为____________。(计算结果保留两位小数)。
的有效氯含量为____________。(计算结果保留两位小数)。
-
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题
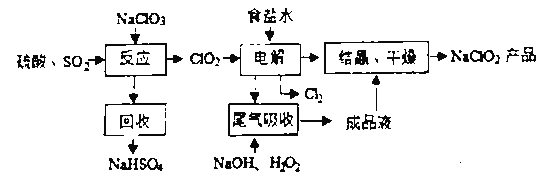
(1)NaClO2中Cl的化合价为______________________.
(2)写出“反应”步骤中生成ClO2的化学方程式._______________________________。
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为_____________________、______________________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应 ,氧化剂与氧化产物的质量之比为_________________,在标况下生成44.8LO2则转移电子的物质的量是____.
,氧化剂与氧化产物的质量之比为_________________,在标况下生成44.8LO2则转移电子的物质的量是____.
(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式._____________________________。
-
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图:
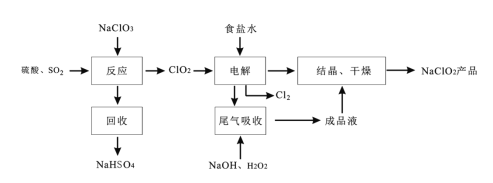
回答下列问题:
(1)NaClO2中Cl的化合价为___;电解产生的Cl2是___色,实验室制备氯气的化学方程式为:____。
(2)写出“反应”步骤中生成ClO2的化学方程式:___。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为___、___。
-
某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验(实验室制取氯气的反应为MnO2 + 4 HCI(浓) MnCl2 + C12↑+ 2 H2O):
MnCl2 + C12↑+ 2 H2O):
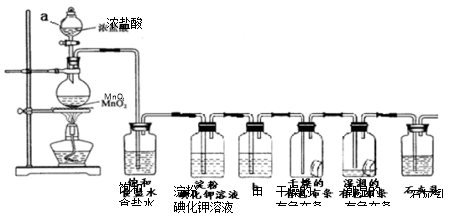
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是_________,反应的离子方程式____________。
(2)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放________(填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为___________________。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2______________L。
-
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置。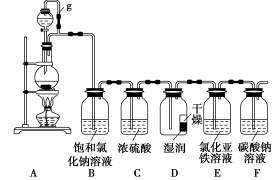
请回答下列问题:
(1)写出实验室制氯气的离子方程式: 。
(2)装置A中g管作用是___________,装置B的作用是 ,装置C的作用是 。
(3)反应一段时间后用注射器从E中抽取少量溶液,检验有Fe3+生成,请写出检验方法________。
(4)已知HCO3-的酸性弱于次氯酸,请写出少量的氯气与F中足量的碳酸钠溶液反应的化学方程式:______________________。
-
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置。

请回答下列问题:
(1)写出实验室制氯气的离子方程式: 。
(2)装置A中g管作用是_________________,装置B的作用是 ,装置C的作用是 。
(3)反应一段时间后用注射器从E中抽取少量溶液,检验有Fe3+生成,请写出检验方法___________。
(4)已知HCO3‑的酸性弱于次氯酸,请写出少量的氯气与F中足量的碳酸钠溶液反应的化学方程式:__________________。

。我国规定饮用水中ClO
的含量应不超过0.20 mg·L-1。测定水样中ClO2、ClO
的含量的过程如下:
+I2。
+I2===S4O
+2I-。
+4H++4I-===Cl-+2I2+2H2O。
的含量是否符合国家规定。








