-
某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
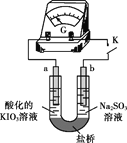
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
| 表盘 | 
| 
|
| 时间/min | 0~t1 | t2~t3 | t4 |
| 偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-
-
某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
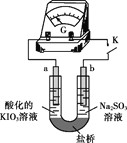
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
| 表盘 | 
| 
|
| 时间/min | 0~t1 | t2~t3 | t4 |
| 偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-
-
某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
| 表盘 | 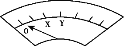
| 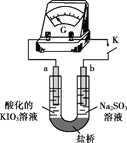
|
| 时间/min | 0~t1 | t2~t3 | t4 |
| 偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-
-
(13分)某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。
(1)查阅资料知NaHSO3与过量KIO3反应分为以下两步进行,第一步为IO3-+ 3HSO3-=3SO42-+3H+ + I-,则第二步反应的离子方程式为_____________________________
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的反应速率的影响。调节反应物浓度和温度进行对比实验,记录如下:
| 实验编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 15 | 20 | 10 | 15 | t1 |
| ② | a | 30 | 0 | 15 | t2 |
| ③ | 15 | b | c | 30 | t3 |
实验①②是探究______________对反应速率的影响,表中a=________;实验①③是探究温度对反应速率的影响,则表中b=________,c=________
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO42-对反应起催化作用,SO42-浓度越大反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
假设三:__________________________________________________________;
……
(4)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
-
【化学—选修5:有机化学基础】(14分)
I、某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入适当过量稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入400 mL 0.5 mol/L的Na2SO3溶液,蓝色恰好完全退去。
(1)写出实验①中反应的离子方程式:_____________________。
(2)实验②的化学反应中转移的电子数为_______________。
(3)以上实验说明:在上述条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是___________________。
II、H2O2既有氧化性又有还原性,在+2价的锰盐或+3价的铬盐等催化下,会发生自身氧化还原反应,生成H2O和O2。完成并配平以下离子方程式:

①反应中的氧化剂是______________;被氧化的元素是____________。
②若化学方程式中KMnO4、H2O2的系数分别是2和7,也能配平这个方程式,但此时H2O2除了跟KMnO4反应外,还发生的反应是(用化学方程式表示)___________________。
-
(12分)某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,进行如下实验:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入适量的稀硫酸,溶液立即变蓝;
(1)写出实验①中发生反应的离子方程式 。
实验②:取适量实验①后的溶液,滴加4 mL 0.5 mol·L—1的亚硫酸钠溶液,蓝色恰好完全褪去。
(2)实验②化学反应中转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。
实验③:取适量实验①后的溶液,继续滴加次氯酸钠溶液,溶液由蓝色变为无色,生成物之一为食盐加碘的原料。
(4)写出实验③中发生反应的离子方程式 。
(5)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-= Cu2+,还原反应式:2Fe3++2e-= 2Fe2+。据此,将反应2Al+2OH—+2H2O = 2AlO2—+3H2↑拆写为两个“半反应式”:氧化反应式: ,还原反应式: 。
-
实验小组利用Na2SO3和浓硫酸制备SO2并进行相关实验探究。实验方案如图。
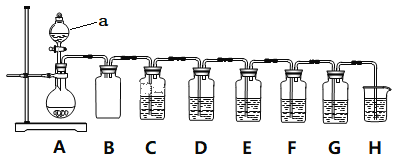
已知:各装置中的试剂,C(品红溶液)、D(酸性KMnO4溶液)、E(H2S溶液)、F(淀粉I2水溶液)、G(H2O2和BaCl2混合液)
(1)仪器组装完后首先要进行的操作是____________________。
(2)仪器a的名称是________________;装置B的作用_____________________。
(3)装置A中发生反应的化学方程式____________________。
(4)装置C和G中的现象:C___________________;G___________________;
(5)设计装置D和E的目的是验证SO2的___________性和___________性。
(6)装置H中的试剂是______________;其作用是_____________________。
(7)F中反应的离子方程式____________________。
-
下列对应化学反应的离子方程式正确的是
A.KIO3与KI在酸性溶液中反应:
B.向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:
C.将过量二氧化硫通入稀氨水中:
D.用稀硝酸洗涤试管内壁的银镜:
-
下列离子方程式书写正确的是 ( )
A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
B.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3- +Ba2++2OH-=BaCO3↓+2H2O+CO32 -
C.Cl2和水反应:Cl2 + H2O =2 H++Cl- + ClO-
D.NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH- NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
-
下列离子方程式书写正确的是( )
A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
B.NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
C.过量SO2通入Ca(ClO)2溶液中:2SO2+H2O+Ca2++2ClO-=Ca(HSO3)2↓+2HClO
D.NH4HSO3溶液与足量NaOH溶液混合加热:NH4++HSO3-+2OH-=NH3+SO32-+2H2O






