-
Na2SO3是一种重要的还原剂。
(1)已知:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq) ∆H=mkJ/mol,O2(g)⇌O2(aq) ∆H=nkJ/mol,则Na2SO3溶液与O2(g)反应的热化学方程式为________。
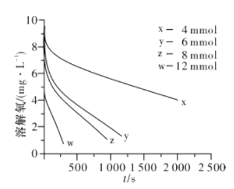
(2)291.5K时1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mg/L,每5s记录溶解氧浓度,实验结果如图所示。当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mg/L,则0~20s内Na2SO3的平均反应速率为________mol∙L-1∙s-1。
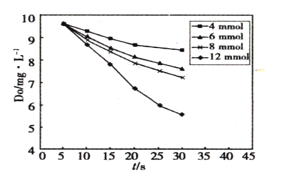
(3)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k∙ca(SO32-),富氧区反应速率方程v=k∙c(SO32-)∙c(O2),k为常数。
①当溶解氧浓度为4.0mg/L,此时Na2SO3的氧化位于贫氧区时,c(SO32-)与速率数值关系如下表所示,则a=________。
| c(SO32-)×10-3 | 3.65 | 5.65 | 7.3 | 11.65 |
| V×106 | 10.2 | 24.5 | 40.8 | 104.4 |
②由富氧区速率方程v=k∙c(SO32-)∙c(O2),当其他条件不变时,SO32-、O2的浓度分别增大为原来的2倍,反应速率为原来的________倍。
(4)两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知ln( )=
)= ,R为常数,则Ea(富氧区)________(填“>”或“<”)Ea(贫氧区)。
,R为常数,则Ea(富氧区)________(填“>”或“<”)Ea(贫氧区)。
| 反应阶段 | 速率方程 | k(297.9K)/k(291.5K) |
| 富氧区 | v=k∙c(SO32-)∙c(O2) | 1.47 |
| 贫氧区 | v=k∙ca(SO32-)∙cb(O2) | 2.59 |
(5)常温下,向H2SO3溶液中逐滴滴加NaOH溶液,混合溶液的pH与离子浓度变化的关系如图所示。(不考虑H2SO3、SO32-的氧化)
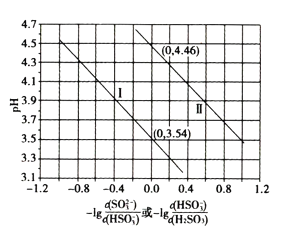
①向H2SO3溶液中滴加NaOH至过量,滴加过程中水的电离程度变化趋势是______。
②由图分析,表示pH与-lg 的变化关系是曲线__________(填“Ⅰ”或“Ⅱ”),亚硫酸的二级电离平衡常数Ka2为_________mol/L(用指数表示)。
的变化关系是曲线__________(填“Ⅰ”或“Ⅱ”),亚硫酸的二级电离平衡常数Ka2为_________mol/L(用指数表示)。
-
Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g) O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
| c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
| 反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
| 富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
| 贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g)  5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
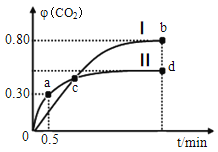
①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
-
Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g) O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
| c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
| 反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
| 富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
| 贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g)  5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
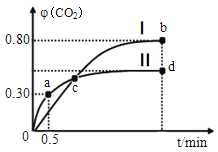
①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
-
I.亚硫酸钠的氧化反应:2Na2SO3 (aq) +O2(aq)=2Na2SO4(aq) ∆H=x kJ/mol。其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。
(1)已知O2(g)  O2(aq) ∆H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
O2(aq) ∆H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
(2)291.5 K时,1.0 L溶液中Na2SO3初始量分别为4、6、8、12 mmol,溶解氧浓度初始值为9.60 mg/L,每5 s记录溶解氧浓度,实验结果如图所示。当Na2SO3初始量为12 mmol,经过20 s溶解氧浓度降为6.40 mg/L,则0~20s内Na2SO3的平均反应速率为_______mol/(L·s)。
(3)为确定贫氧区速率方程v=k·ca(SO32-)·cb(O2)中的a、b的值(取整数),分析实验数据。
| c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,则a=____。
②当溶解氧浓度小于4.0mg/L时,图中曲线皆为直线,Na2SO3氧化速率与溶解氧浓度无关,则b=_______。
(4)两个阶段不同温度的速率常数之比如表(乙)所示。已知 ,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
| 反应阶段 | 速率方程 | 
|
| 富氧区 | v=k·c (SO32-)·c (O2) | 1.47 |
| 贫氧区 | v=k·ca (SO32-)·cb(O2) | 2.59 |
II. (5)在容积固定的密闭容器中,起始充入0.2 mol SO2和0.1 mol O2,反应体系起始总压强0.1MPa。反应在一定温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=________ ( 分压=总压×物质的量分数)(写单位)。
(6)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极反应式_________________________。
-
Na2S2O3应用广泛,水处理中常用作还原剂、冶金中常用作络合剂。
(1)Na2S2O3的实验室制法:装置如图(加热和夹持装置略):
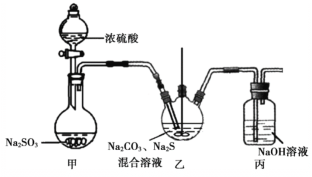
已知:2Na2S + 3SO2 = 2Na2SO3 + 3S↓ 、Na2SO3 + S = Na2S2O3
①甲中发生反应的化学方程式为______。
②实验过程中,乙中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3。一段时间后,乙中再次出现少量浑浊,此时须立刻停止通入SO2。结合离子方程式解释此时必须立刻停止通入SO2的原因:______。

③丙中,NaOH溶液吸收的气体可能有______。
(2)实际工业生产中制得的Na2S2O3溶液中常混有少量Na2SO3,结合溶解度曲线(如图),获得Na2S2O3•5H2O的方法是______。
(3)Na2S2O3的用途:氨性硫代硫酸盐加热浸金是一种环境友好的黄金(Au)浸取工艺。
已知:I. Cu(NH3)42+=Cu2++4NH3;
II. Cu2+在碱性较强时受热会生成CuO沉淀。
①将金矿石浸泡在Na2S2O3、Cu(NH3)42+的混合溶液中,并通入O2。浸金反应的原理为:
i.Cu(NH3)42+ + Au + 2S2O32− Cu(NH3)2+ + Au(S2O3)23−+ 2NH3
Cu(NH3)2+ + Au(S2O3)23−+ 2NH3
ii.4Cu(NH3)2+ + 8NH3+ O2 + 2H2O = 4Cu(NH3)42+ + 4OH−
浸金过程Cu(NH3)42+起到催化剂的作用,金总反应的离子方程式为:______。
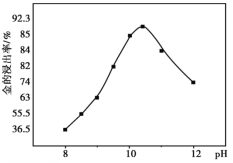
② 一定温度下,相同时间金的浸出率随体系pH变化曲线如如图,解释pH>10.5时,金的浸出率降低的可能原因_______。(写出2点即可)
-
下列说法正确的是( )
A.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H>0
B.Al2(SO4)3溶液蒸干所得固体产物为Al(OH)3
C.电解NH4Cl和HCl混合溶液可在阴极生成NCl3
D.等体积AgCl、AgI饱和清液混合后加入足量AgNO3固体,生成沉淀物质的量:n(AgCl)>n(AgI)
-
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。

Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是___________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:____________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O32—+I2===S4O62—+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。

Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42—,常用作脱氯剂,该反应的离子方程式为____________。
-
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。

Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是___________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:____________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O32—+I2=S4O62—+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。

Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42—,常用作脱氯剂,该反应的离子方程式为____________。
-
Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O3•5H2O 反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
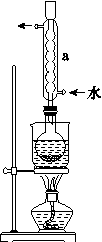
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)仪器a的名称是 ,其作用是 。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(3)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因: 。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾1碘的标准溶液滴定,滴定至终点时,消耗标准溶液的体积为18.10 mL。
反应原理为:2S2O32‾+I2=S4O62-+2I‾
(4)滴定至终点时,溶液颜色的变化: 。
(5)产品的纯度为(设Na2S2O3•5H2O相对分子质量为M) 。
III.Na2S2O3的应用
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42‾,常用作脱氧剂,该反应的离子方程式为 。
-
(题文)掺杂硒的纳米氧化亚铜常用作光敏材料、能源行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO2和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)=Se(s)+2H2SO4(aq) △H1
2H2SeO4(aq)+Se(s)+H2O(l)=3H2SeO3(aq) △H2
H2SeO4(aq)+3SO2(g)+2H2O(l)=Se(s)+3H2SO4(aq) △H3
则△H2=_____________(用△H1和△H3表示)。
(2)H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS) ,羰基硫的结构式为____________________。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示,

①阳极的电极反应式为_________________________。
②电解一段时间后,向电解液中补充一定量的_________________可将溶液恢复至初始状态。
(4)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)  CH3OH(g) △H=akJ·mol-1。
CH3OH(g) △H=akJ·mol-1。
按 =1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
=1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
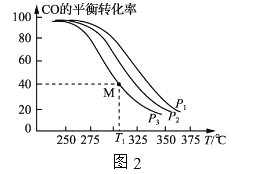
①a_____(填“>”或“<”)0;压强p1、p2、p3由小到大的顺序是___________________。
②T1℃时若向该容器中充入2. 0 mol H2和2.0 molCO发生上述反应,5 min后反应达到平衡(M点),则0~5 min内,v(H2)=____ mol·L-1·min-1,M点对应条件下反应的平衡常数
为________________。
(5)将CuCl水解再热分解可得到纳米Cu2O。CuCl 水解的反应为CuC(s) +H2O(l)  CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________________。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________________。

)=
,R为常数,则Ea(富氧区)________(填“>”或“<”)Ea(贫氧区)。

的变化关系是曲线__________(填“Ⅰ”或“Ⅱ”),亚硫酸的二级电离平衡常数Ka2为_________mol/L(用指数表示)。








