-
I.亚硫酸钠的氧化反应:2Na2SO3 (aq) +O2(aq)=2Na2SO4(aq) ∆H=x kJ/mol。其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。
(1)已知O2(g)  O2(aq) ∆H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
O2(aq) ∆H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
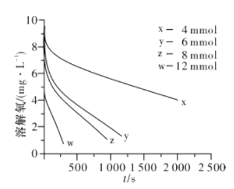
(2)291.5 K时,1.0 L溶液中Na2SO3初始量分别为4、6、8、12 mmol,溶解氧浓度初始值为9.60 mg/L,每5 s记录溶解氧浓度,实验结果如图所示。当Na2SO3初始量为12 mmol,经过20 s溶解氧浓度降为6.40 mg/L,则0~20s内Na2SO3的平均反应速率为_______mol/(L·s)。
(3)为确定贫氧区速率方程v=k·ca(SO32-)·cb(O2)中的a、b的值(取整数),分析实验数据。
| c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,则a=____。
②当溶解氧浓度小于4.0mg/L时,图中曲线皆为直线,Na2SO3氧化速率与溶解氧浓度无关,则b=_______。
(4)两个阶段不同温度的速率常数之比如表(乙)所示。已知 ,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
| 反应阶段 | 速率方程 | 
|
| 富氧区 | v=k·c (SO32-)·c (O2) | 1.47 |
| 贫氧区 | v=k·ca (SO32-)·cb(O2) | 2.59 |
II. (5)在容积固定的密闭容器中,起始充入0.2 mol SO2和0.1 mol O2,反应体系起始总压强0.1MPa。反应在一定温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=________ ( 分压=总压×物质的量分数)(写单位)。
(6)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极反应式_________________________。
-
Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g) O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
| c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
| 反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
| 富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
| 贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g)  5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
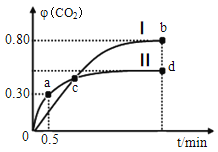
①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
-
Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g) O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
| c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
| 反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
| 富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
| 贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g)  5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
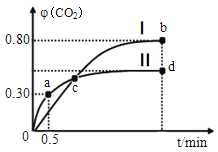
①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
-
I.已知:① NaHCO3(s)==Na+(ag)+HCO3-(aq) △H=+18.81kJ·mo1-1
②Na2CO3(s)==2Na+(aq)+CO2(aq) △H=-16.44 k J· mol-1
③2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(1) △H=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热 NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因_________________________________。
(2) NaHCO3溶液中主要存在2种化学平衡:a.HCO3-+H2O H2CO3+OH-,b.2HCO3-
H2CO3+OH-,b.2HCO3- CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图1所示(不考虑相互影响):
CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图1所示(不考虑相互影响):
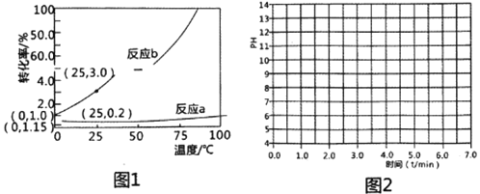
①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为__________mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是___________。
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
| c(mo1·L-1) | 饱和 | 0.20 | 0.10 | 0.010 | 0.0010 |
| pH | 12.1 | 11.8 | 11.5 | 11.1 | 10.6 |
请在图2中作出 NaHCO3溶液pH随时间变化曲线_________________
II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图
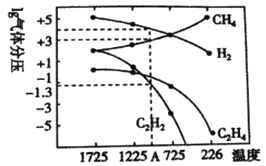
(1)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4),CH4的平衡转化率为___________;上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,且平衡时,c (CH4)=2c(C2H4),则t=___________s;
C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4),CH4的平衡转化率为___________;上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,且平衡时,c (CH4)=2c(C2H4),则t=___________s;
(2)列式计算反应2CH4(g) C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
(3)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有_________________________________。
-
Na2SO3是一种重要的还原剂。
(1)已知:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq) ∆H=mkJ/mol,O2(g)⇌O2(aq) ∆H=nkJ/mol,则Na2SO3溶液与O2(g)反应的热化学方程式为________。
(2)291.5K时1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mg/L,每5s记录溶解氧浓度,实验结果如图所示。当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mg/L,则0~20s内Na2SO3的平均反应速率为________mol∙L-1∙s-1。
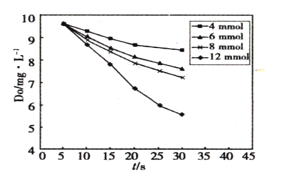
(3)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k∙ca(SO32-),富氧区反应速率方程v=k∙c(SO32-)∙c(O2),k为常数。
①当溶解氧浓度为4.0mg/L,此时Na2SO3的氧化位于贫氧区时,c(SO32-)与速率数值关系如下表所示,则a=________。
| c(SO32-)×10-3 | 3.65 | 5.65 | 7.3 | 11.65 |
| V×106 | 10.2 | 24.5 | 40.8 | 104.4 |
②由富氧区速率方程v=k∙c(SO32-)∙c(O2),当其他条件不变时,SO32-、O2的浓度分别增大为原来的2倍,反应速率为原来的________倍。
(4)两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知ln( )=
)= ,R为常数,则Ea(富氧区)________(填“>”或“<”)Ea(贫氧区)。
,R为常数,则Ea(富氧区)________(填“>”或“<”)Ea(贫氧区)。
| 反应阶段 | 速率方程 | k(297.9K)/k(291.5K) |
| 富氧区 | v=k∙c(SO32-)∙c(O2) | 1.47 |
| 贫氧区 | v=k∙ca(SO32-)∙cb(O2) | 2.59 |
(5)常温下,向H2SO3溶液中逐滴滴加NaOH溶液,混合溶液的pH与离子浓度变化的关系如图所示。(不考虑H2SO3、SO32-的氧化)
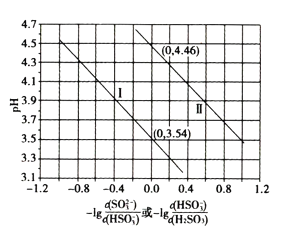
①向H2SO3溶液中滴加NaOH至过量,滴加过程中水的电离程度变化趋势是______。
②由图分析,表示pH与-lg 的变化关系是曲线__________(填“Ⅰ”或“Ⅱ”),亚硫酸的二级电离平衡常数Ka2为_________mol/L(用指数表示)。
的变化关系是曲线__________(填“Ⅰ”或“Ⅱ”),亚硫酸的二级电离平衡常数Ka2为_________mol/L(用指数表示)。
-
I.研究发现,氮氧化物和硫氧化物是雾霾的主要成分。回答下列问题:
(1)有下列反应:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
②C(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol
③2C(s)+O(g)=2CO(g) △H3=-221.0 kJ/mol
已知某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式: _________________。
,请写出此反应的热化学方程式: _________________。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g) 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。
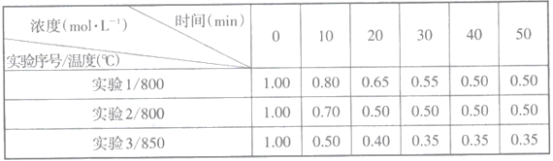
①下列说法正确的是___________(填正确选项的序号)
A.实验2容器内压强比实验1的小
B.由实验2和实验3可判断该反应是放热反应
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
E.在0→10mim内实验2的反应速率υ(O2)=0.015mol/(L·min)
②不能判断反应已达到化学平衡状态的是___________(填正确选项的序号)
A.容器内的气体压强不变 B.2υ正(NO2)=υ逆(O2)
C.气体的平均相对分子质量保持不变 D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为 P0kPa,在800℃温度下该反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将___________(填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
(3)为了减少雾霾中的SO2,工业尾气中SO2可用饱和Na2SO3溶液吸收,该反应的化学方程式为___________;25℃时,若用1mol/L的Na2SO3溶液吸收SO2,当恰好完全反应时,溶液的pH___________7(填“大于”或“小于”或“等于”),溶液中各离子浓度由大到小的顺序为______________(已知:常温下H2SO3的电离常数Ka1=1.3×10-2,Ka2=6.2×10-8)。
-
某废水中含有的NH 在一定条件下可被O2氧化,反应过程如下:
在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH = -273kJ/mol
②NO2-(aq)+1/2O2(g)=NO3-(aq) ΔH = -73kJ/mol
下列叙述不正确的是
A.1mol的NH3和1mol 的NH4+都有10×6.02×1023个电子
B.室温下,0.1 mol/L HNO2溶液pH>1,则NaNO2溶液显碱性
C.NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH= -346kJ/mol
D.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱
-
某废水中含有的NH 在一定条件下可被O2氧化,反应过程如下:
在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH = -273kJ/mol
②NO2-(aq)+1/2O2(g)=NO3-(aq) ΔH = -73kJ/mol
下列叙述不正确的是
A. 1mol的NH3和1mol 的NH4+都有10×6.02×1023个电子
B. 室温下,0.1 mol/L HNO2溶液pH>1,则NaNO2溶液显碱性
C. NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH= -346kJ/mol
D. 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱
-
某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) △H=-273kJ·mol-1
②NO2-(aq)+1/2O2(g)=NO3-(aq) △H=-73kJ·mol-1
下列说法正确的是( )
A.1mol的NH3和1mol的NH4+都有10×6.02 ×1023个质子
B.室温下,NH4NO2溶液呈酸性,则说明Ka(HNO2)< Kb(NH3·H2O)
C.NH4+(aq)+2O2(g) NO3—(aq)+2H+(aq)+H2O(l);△H= - 346kJ/mol
D.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱
-
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
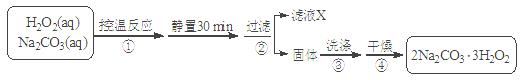
已知:主反应:2Na2CO3(aq) + 3H2O2(aq) 2Na2CO3·3H2O2(s) ΔH < 0
2Na2CO3·3H2O2(s) ΔH < 0
副反应:2H2O2= 2H2O + O2↑;50℃时2Na2CO3·3H2O2(s) 开始分解。
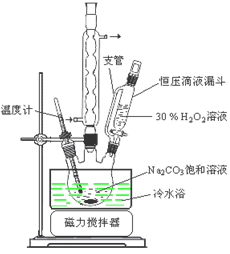
请回答下列问题:
(1)步骤①的关键是 ,原因是 。
(2)在滤液X中加入适量NaCl固体目的是_________________。
(3)步骤③中选用无水乙醇洗涤产品的目的是 。
(4)下列物质中,会引起过碳酸钠失效的有 。
| A.NaHCO3 | B.Na2SO3 | C.Na2SiO3 | D.HCl |
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶解→加入BaCl2溶液→过滤→洗涤→干燥→称量。需要直接测定的物理量有: (用字母表示并注明其含义)。产品中过碳酸钠质量分数的表达式为: 。
O2(aq) ∆H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。

,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。








