-
能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)已知H2(g)、CO(g)和CH3OH(l )的燃烧热△H分别为285.8kJ·mol1、283.0kJ·mol1和726.5kJ·mol1。请回答下列问题:
①写出表示H2燃烧热的热化学反应方程式____________________。
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________________。
(2)以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ.CH4(g)+H2O(g)= CO(g)+3H2(g) △H=+206.0kJ/mol
Ⅱ.CO(g)+2H2(g)= CH3OH(g) △H=-129.0kJ/mol
①将2.0mol CH4和1.0mol H2O(g)通入容积为2L的反应容器,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如图。在100℃时达到平衡所需的时间为5min,则用CO表示该反应的平均反应速率为_________________。100℃时反应Ⅰ的平衡常数为_________________。
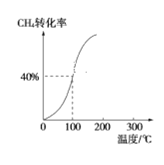
②工业上利用甲醇制备氢气的常用方法有甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)  CO(g)+2H2(g),请描述在其他条件不变时,温度对甲醇转化率的影响:____________________。
CO(g)+2H2(g),请描述在其他条件不变时,温度对甲醇转化率的影响:____________________。
-
能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.以CH4和H2O为原料,通过下列反应来制备甲醇.
①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol
(l)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______.
(2)将1.0molCH4和2.0molH2O(g)通过容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.

①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为______;
②100℃时反应I的平衡常数为______.
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的 ,其他条件不变,对平衡体系产生的影响是______(填字母序号).
,其他条件不变,对平衡体系产生的影响是______(填字母序号).
A.c(H2)减小 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时 减小 E.平衡常数K增大
减小 E.平衡常数K增大
(4)工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸气重整法.该法中的一个主要反应为CH3OH(g)⇌CO(g)+2H2(g),此反应能自发进行的原因是:______.
②甲醇部分氧化法.在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示.则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为______
-
能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(1)已知:在25℃、101kPa下,1mol甲烷燃烧生成CO2和液态水时放热890.31kJ。请写出甲烷燃烧热的热化学方程式__________。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃) 。
CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃) 。
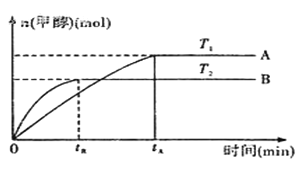
①合成甲醇反应的△H__________(填“>”、“<”或“=”)0。
②平衡常数的表达式为:__________。温度为T2时的平衡常数__________(填“>”、“<”或“=”)温度为T1时的平衡常数。
-
能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为-285.8 kJ·mol-1、-282.5 kJ·mol-1、-726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)===CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为
A.CO(g)+2H2(g)===CH3OH(g) ΔH=+127.4 kJ·mol-1
B.CO(g)+2H2(g)===CH3OH(l) ΔH=+127.4 kJ·mol-1
C.CO(g)+2H2(g)===CH3OH(g) ΔH=-127.4 kJ·mol-1
D.CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4 kJ·mol-1
-
能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ·mol-1、282.5kJ·mol-1、726.7kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)===CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4kJ·mol-1
B.CO(g)+2H2(g)===CH3OH(l) ΔH=+127.4kJ·mol-1
C.CO(g)+2H2(g)===CH3OH(g) ΔH=-127.4kJ·mol-1
D.CO(g)+2H2(g)===CH3OH(g) ΔH=+127.4kJ·mol-1
-
能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ·mol-1、282.5kJ·mol-1、726.7kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)===CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A. CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4kJ·mol-1
B. CO(g)+2H2(g)===CH3OH(l) ΔH=+127.4kJ·mol-1
C. CO(g)+2H2(g)===CH3OH(g) ΔH=-127.4kJ·mol-1
D. CO(g)+2H2(g)===CH3OH(g) ΔH=+127.4kJ·mol-1
-
(8分)能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质。一定条件下,在体积为2 L的密闭容器中,1mol一氧化碳与2mol氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
根据题意完成下列各题:
反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,10min反应达平衡,此时甲醇的物质的量浓度为0.3mol/L,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(3)在其它条件不变的情况下,把反应处于平衡体系的容器的体积压缩为1 L,下列有关该体系的说法正确的是 。
A.平衡向正反应方向移动 B.正反应速率加快,逆反应速率减慢
C.甲醇的物质的量增加 D.重新平衡时c(CO)/c(CH3OH)不变
-
(8分)能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为 。


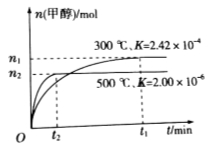
 ;在容积为1L的密闭容器中分别充入1mol CO和2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的
;在容积为1L的密闭容器中分别充入1mol CO和2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的 (填“<”“>”或“=”)0。
(填“<”“>”或“=”)0。
(2)利用工业废水中的CO2可制取甲醇,其反应为

 。
。
①已知下列反应的能量变化如图所示:
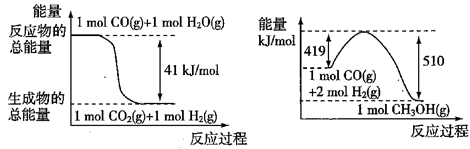
由二氧化碳和氢气制备甲醇的热化学方程式为 。
②为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示,从反应开始到平衡, .
.
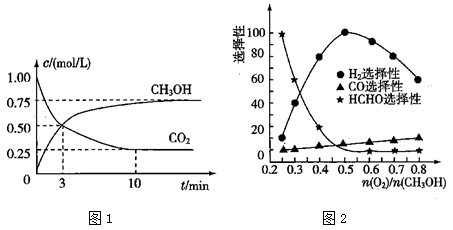
(3)工业上可利用甲醇部分氧化法制取氢气。在一定温度下以 为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示。在制备H2时最好控制
为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示。在制备H2时最好控制 = 。
= 。
-
(13分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1________0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)= 0.8 mol/L,则CO的转化率为________,此时的温度为________(从上表中选择)。
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是________________。
 a、容器各物质的浓度保持不变; b、容器内压强保持不变;
a、容器各物质的浓度保持不变; b、容器内压强保持不变;
c、υ(CO)消耗==1/2υ(H2)生成 d 、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:________。
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下)。请根据图示回答下列问题:
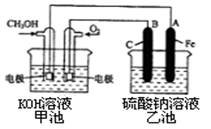
① 通入甲醇蒸气的电极应为________________________极(填写“正”或“负”), 该电极上发生的电极反应是________(填字母代号)。
a.2CH3OH —12 e- +3O2 === 2CO2 + 4 H2O
b.CH3 OH—6 e- + 8 OH- === CO32- + 6H2O
c.O2 + 2H2O + 4 e- === 4OH-
d.O2— 4 e- + 4H+ === 2H2O
②写出电极A的名称________。写出B电极的电极反应式________。
③当酸性甲醇燃料电池消耗3.36 L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是________。
-
23.(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g)  CH3OH(g) ΔH;
CH3OH(g) ΔH;
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①根据表中数据可判断ΔH 0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为: ,随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为: ;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为 mL(标况下)。

CO(g)+2H2(g),请描述在其他条件不变时,温度对甲醇转化率的影响:____________________。





