-
在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为______。
(2)Na、O、S简单离子半径由大到小的顺序为___________(用简单离子符号表示离子半径)。
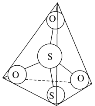
(3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为________。
(4)Na3[Ag(S2O3)2]中存在的作用力有_____________。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为____________________;与SO3相比,____________的键角更大,原因是________________________________。
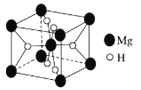
(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为____________________,已知该晶体的密度为ρg/cm3,则该晶胞的体积为_________ cm3(用含ρ、NA的代数式表示)。
-
在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态银原子的最外层电子排布式为 _______。
(2)Na、O、S简单离子半径由大到小的顺序为______________________。
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为_______________________。
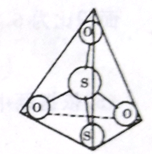
(4)写出AgBr 溶于Na2S2O3溶液的离子反应方程式______________。Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、______________。
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2 分子中硫原子的价层电子对数为_________,其分子空间构型为______________。 SO2易溶于水,原因是________________________________。
(6)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图象的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol -1,试通过这些数据列出计算阿伏加德罗常数的算式______________________________。
-
在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态铜原子的价电子排布式为___。
(2)Na、O、S简单离子半径由大到小的顺序为___。
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为___。
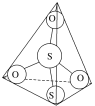
(4)Na3[Ag(S2O3)2]中存在的作用力有__。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子中硫原子的价层电子对数为__,其分子空间构型为___。SO2易溶于水,原因是__。
(6)SO2具有较强的还原性,碳与熔融金属钾作用,形成的晶体是已知最强的还原剂之一,碳的某种晶体为层状结构,钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图所示,则其化学式可表示为___。
(7)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图像的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol-1,试通过这些数据列出计算阿伏加德罗常数的算式___。
-
在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加人Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态银原子的最外层电子排布式为 _______。
(2)Na、O、S简单离子半径由大到小的顺序为______________________。
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为_______________________。
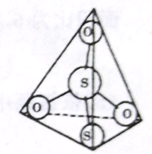
(4)写出AgBr 溶于Na2S2O3溶液的离子反应方程式______________。Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、______________。
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2 分子中硫原子的价层电子对数为_________,其分子空间构型为______________。 SO2易溶于水,原因是________________________________。
(6)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图象的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol -1,试通过这些数据列出计算阿伏加德罗常数的算式______________________________。
-
照相底片定影时,常用定影液硫代硫酸钠( )溶解未曝光的溴化银(
)溶解未曝光的溴化银( ),生成含
),生成含 的废定影液再向其中加入
的废定影液再向其中加入 使
使 中的银转化为
中的银转化为 ,使定影液再生。将
,使定影液再生。将 在高温下转化为Ag,达到回收银的目的。回答下列问题:
在高温下转化为Ag,达到回收银的目的。回答下列问题:
(1)元素周期表中,铜、银、金位于同一副族相邻周期,则基态银原子的最外层电子排布式为__________________。
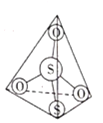
(2) 离子结构如图所示,其中心硫原子的杂化方式为___________。基态S原子中,核外电子占据的最高能级的符号是__________,占据最高能级电子的电子云轮廓图为________形。
离子结构如图所示,其中心硫原子的杂化方式为___________。基态S原子中,核外电子占据的最高能级的符号是__________,占据最高能级电子的电子云轮廓图为________形。
(3)写出 溶于
溶于 溶液反应的离子方程式______。
溶液反应的离子方程式______。 中存在的作用力有离子键、共价键、__________。
中存在的作用力有离子键、共价键、__________。
(4)在空气中灼烧 生成
生成 和
和 ,
, 分子的空间构型为__________。分子中的大
分子的空间构型为__________。分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数n代表参与形成大
键的原子数n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为_________。
键应表示为_________。
(5) 的键角小于
的键角小于 的键角,原因是_________________。
的键角,原因是_________________。
(6)用X射线衍射法可测定阿伏加德罗常数。由金的X射线衍射图像可知金的晶胞属于面心立方晶胞。若金原子的半径为 ,金的密度为
,金的密度为 ,摩尔质量为
,摩尔质量为 ,列出计算阿伏加德罗常数的算式_________(用含
,列出计算阿伏加德罗常数的算式_________(用含 的表达式表示)。
的表达式表示)。
-
在胶片冲洗时可用硫代硫酸钠(Na2S2O3)做定影液,与胶片上未曝光的AgBr反应生成可溶性离子Ag(S2O3)23-。该有关过程的离子方程式不合理的是
A.H2S2O3溶液显弱酸性的原因是:H2S2O3  H+ + HS2O3-
H+ + HS2O3-
B.Na2S2O3溶液显碱性的原因是:S2O32-+2 H2O  H2S2O3 + 2OH-
H2S2O3 + 2OH-
C.Na2S2O3和AgBr反应的离子方程式是:2S2O32- + AgBr  Ag(S2O3)23- + Br-
Ag(S2O3)23- + Br-
D.定影不能在酸性较强的溶液中进行的原因是:S2O32-+ 2H+= S↓+ SO2↑+ H2O
-
氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3===Na3[Ag(S2O3)2]+NaBr。回答下列问题:
(1)基态S的价电子排布图为____________。
(2)下列关于物质结构与性质的说法,正确的是________。
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测 的空间构型为______,中心原子S的杂化方式为________,[Ag(S2O3)2]3-中存在的化学键有________(填字母)。
的空间构型为______,中心原子S的杂化方式为________,[Ag(S2O3)2]3-中存在的化学键有________(填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
| 元素 | Al | Si | P | S | Cl |
| E1/(kJ·mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因___________。
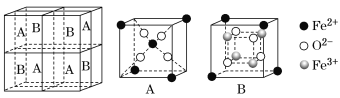
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B组成。则该氧化物的化学式为_____,已知该晶体的晶胞参数为a nm,阿伏加德罗常数的值为NA,则密度ρ为______g·cm-3(用含a和NA 的代数式表示)。
-
硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式为:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。下列说法正确的是
A.基态Br原子中电子的空间运动状态有35种 B.[Ag(S2O3)2]3-中含有离子键、共价键、配位键
C. 中心原子S的杂化方式为sp3 D.非金属元素S、O、Br中电负性最大的是Br
中心原子S的杂化方式为sp3 D.非金属元素S、O、Br中电负性最大的是Br
-
硫代硫酸钠(Na2S2O3),又名大苏打、海波,它是无色透明的单斜晶体,熔点48℃。硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应原理为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。
Ⅰ.为了从废定影液中提取 AgNO3,设计如下实验流程。
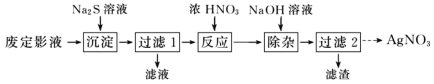
(1)“沉淀”步骤中生成 Ag2S 沉淀,检验沉淀完全的操作是________。
(2)“反应”步骤中会生成淡黄色固体,该反应的化学方程式为________。
(3)“过滤 2”的溶液获取 AgNO3晶体的操作是蒸发浓缩、冷却结晶、________、________、干燥。
Ⅱ.下图是实验室模拟工业制备 Na2S2O3 的装置图。
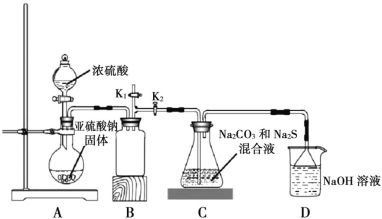
依据图示回答下列问题:
(4)装置 A 中盛放亚硫酸钠固体的玻璃仪器名称是________,装置 B 的作用是________。
(5)分液漏斗中如直接用 98%的浓硫酸,烧瓶中固体易产生“结块”现象,使反应速率变慢。产生“结块”现象的原因是________。
(6)设置 K1导管的目的是为了防止拆除装置时造成空气污染。请简述操作方法________。
(7)硫代硫酸钠还可用于除去鞣制皮革时过量的重铬酸盐,将其还原成 Cr3+,理论上处理1mol Cr2O72-需要 Na2S2O3的质量为________。
-
Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(Ⅰ)S2O32-能被I2氧化为S4O62-;
(Ⅱ)酸性条件下S2O32-迅速分解为S和SO2;
(Ⅲ)向Na2S2O3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品中常含有少量Na2SO3和Na2SO4。
实验室可用如下装置(略去部分夹持仪器)模仿生成过程。
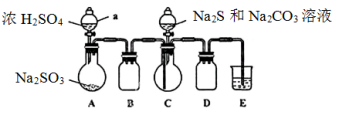
实验步骤:
(1)仪器组装完成后, ,则整个装置气密性良好。装置D的作用是 ,装置E中溶液的作用是 。
(2)先向C中烧瓶加入Na2S2O3和Na2S混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)等Na2S2O3和Na2S完全消耗后,结束反应。过滤C中混合物,将溶液蒸发、结晶、过滤、洗涤、干燥,得到产品。
(4)为验证产品中含有硫酸盐,该小组设计了以下实验方案,请将方案补充完整。
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 | |
| 步骤3:静置后取上清液,加入BaCl2溶液 | |
(5)利用KMnO4标准溶液可以定量测定硫代硫酸钠试剂的纯度,步骤为:
①溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL0.01mol·L-1 KMnO4标准溶液,加硫酸酸化,再加过量KI溶液。写出该反应的离子反应:
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32- +I2 S4O62- +2I-),记录Na2S2O3溶液用量,滴定3次。指示剂最好选用 ,本次滴定时所用的玻璃仪器除锥形瓶外,还有 。
S4O62- +2I-),记录Na2S2O3溶液用量,滴定3次。指示剂最好选用 ,本次滴定时所用的玻璃仪器除锥形瓶外,还有 。
④若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 。










